Никель, Ni, атомный номер 28
Цена, происхождение, добыча и использование никеля
Никель - это химический элемент с символом Ni и атомным номером 28. Он относится к переходным металлам, в периодической таблице он стоит после более старого метода подсчета в 8. Подгруппа или железо-платиновая группа, согласно более новому в группе 10 или никелевой группе.
история
Никель был впервые представлен чисто Акселем Фредериком Кронштедтом 1751 и назван в честь минерала мельхиора (шведский коппарникель, сегодня Никкелин), в котором он нашел неизвестный до сих пор металл.
Средневековые шахтеры использовали термин мельхиор для обозначения руды, которая выглядела как медная руда, но из которой не могла быть получена медь, как если бы она была околдована горными духами («никель»). Подобная кобольдоподобная этимология может быть найдена в кобальте.
Первой монетой из чистого никеля была чеканка 1881.
Вхождение
Никель встречается в земной коре с содержанием около 0,008%. Геофизические и геохимические данные свидетельствуют о том, что большая часть никеля находится на Земле и других земных планетах в ядре, где он образует сплав с железом и некоторыми легкими элементами. В ядре Земли его массовая доля по последним моделям составляет около 5,2%.
Твердое вещество, то есть в элементарной форме никель, встречается редко. Пока что только о местах хранения 50 для твердого никеля задокументировано (2018), в том числе в Австралии, Китае, Канаде, России и Соединенных Штатах Америки.
Традиционно большая часть производства никеля производится из сульфидных руд, таких как пентландит (около 34% никеля), никелевый магнитный гравий (пирротин и агломерат пентандита) и некоторые другие минералы никеля, такие как миллерит (около 64-65% никель) и никель (около 44% Никель) победил. Кроме того, латеритовые никелевые руды, в основном от Garnierit, смеси Népouit (около 46% никеля) и Willemseit (около 29% никеля), добываются в качестве сырья для производства никеля. В целом, некоторые никелевые минералы 200 известны на сегодняшний день, а некоторые имеют намного более высокое содержание никеля, чем уже упоминалось, но встречаются гораздо реже, чем эти. Например, очень редкий бунсенит - это минерал с самым высоким содержанием никеля до 78,58%. В равной степени редкие минералы Heazlewoodite и Awaruit содержат между 72 и 73% никеля.
Из-за эксплуатации классических сульфидных месторождений добыча смещается в сторону латеритных никелевых руд. Тем не менее, они должны быть тщательно получены путем кислотного выщелачивания под высоким давлением (английское кислотное выщелачивание под высоким давлением).
Чтобы иметь возможность экономически разлагать никель, содержание никеля в руде должно составлять не менее 0,5%. Наиболее важные случаи встречаются в Канаде (бассейн Садбери), Новой Каледонии, России (Норильск и Кольский полуостров), Австралии (Квинсленд) и Кубе (Моа Бэй и Никаро). Обычным спутником никеля является кобальт.
Никель как минерал

Природный никель в его элементарной форме был впервые описан Полом Рамдором 1967 и признан Международной минералогической ассоциацией (IMA) как независимый минеральный вид (внутренний входной номер IMA: 1966-039).
Согласно классификации минералов по Strunz (издание 9) никеля по системе нет. 1.AA.05 (Элементы - металлы и интерметаллические соединения - семейство медных купалитов - медная группа) соответственно в устаревшем 8. Издание перечислено под I / A.04b (никелевая серия). Классификация минералов по Дане, которая преимущественно используется в англоязычных странах, приводит элемент минерал по системе №. 01.01.11.05 (железо-никелевая группа).
Тип местности - полуостров Богота около Каналы в северной провинции Новой Каледонии, где обнаружен самородный никель в форме идиоморфных кубических зерен или вросших кубиков до 0,1 мм в виде включений в Heazlewoodite и в виде нерегулярной массы «пауков» между Heazlewooditkörnern. Сопровождающие минералы в дополнение к Heazlewoodite включают халькопирит, халькоцит, галенит, годлевскит, твердую медь, миллерит, орцелит, пентландит, пирит и пирротин.
Извлечение и презентация
Большая часть никеля добывается из никелевых и медьсодержащих железных руд, таких как никелевый магнитный гравий. Чтобы сделать добычу экономически выгодной, никель сначала должен быть обогащен путем флотации до содержания никеля около пяти процентов. Затем руда обжаривается аналогично производству меди. Здесь руду сначала предварительно обжаривают для превращения части сульфида железа в оксид железа. Впоследствии силикаты и кокс добавляют к шлаку оксида железа в виде силиката железа. В то же время медно-никелевый необработанный камень образуется из сульфида никеля, меди и железа. Так как это особенно тяжелее, чем железо-силикатный шлак, две фазы могут быть нарезаны отдельно.
Затем грубый камень заполняется в конвертере и добавляется кремнезем. Вводится кислород. В результате оставшийся сульфид железа обжаривают до оксида железа и затем очищают. В результате получается медно-никелевый тонкий камень, который содержит около 80% меди и никеля и около 20% серы.
| Позиция | Земля | Производство (в млн т) |
|---|---|---|
| 1 | Индонезия | 400.000 |
| 2 | Филиппины | 230.000 |
| 3 | Каледонии | 210.000 |
| 4 | Канада | 210.000 |
| 5 | Австралия | 190.000 |
| 6 | Россия | 180.000 |
| 7 | Бразилия | 140.000 |
| 8 | Китайская Народная Республика | 98.000 |
| 9 | Гватемала | 68.000 |
| 10 | Куба | 51.000 |
Добыча Роникеля
Для извлечения Rohnickels никель должен быть отделен от меди. Для этого тонкий камень сплавляют с сульфидом натрия Na2S. Между медью и сульфидом натрия образуется только слабый двойной сульфид. Образуются две легко разделяемые фазы: двойной сульфид меди (натрия) и сульфид никеля. После отделения сульфид никеля обжигается до оксида никеля и затем восстанавливается до никеля с помощью кокса.
Для извлечения чистого никеля Роникель очищается электролизом. Для этой цели Rohnickel соединен в качестве анода, Nickelelfeinblech в качестве катода в электролизере. Используемый электролит представляет собой раствор соли никеля. Во время электролиза никель и все менее благородные компоненты переходят в раствор на аноде. Все благородные компоненты остаются твердыми и попадают под электрод в качестве анодного шлама. Это служит важным источником для производства драгоценных металлов, таких как золото или платина. На катоде ионы никеля из раствора восстанавливаются до никеля, все менее благородные компоненты остаются в растворе. Чистота электролитического никеля составляет около 99,9%.
Для извлечения чистого никеля с чистотой 99,99% существует специальный процесс Луны, названный в честь Людвига Луны, который открыл 1890 тетракарбонил никеля. Этот процесс основан на образовании и разложении тетракарбонила никеля. Для этой цели мелкодисперсный порошок Рохникеля вводят в поток оксида углерода при 80 ° C. Это образует газообразный никель тетракарбонил. Он освобождается от пыли дымовых газов и направляется в камеру горячего разложения 180 ° C. Внутри маленькие никелевые шарики. В этот момент тетракарбонил никеля снова разлагается до никеля и оксида углерода. В результате получается очень чистый никель.
представление труда
Существуют различные методы для представления небольших количеств очень чистого никеля в лаборатории:
Восстановление оксида водородом при 150 ° C до 250 ° C:
Восстановление суспензии хлорида никеля (II) в диэтиловом эфире с помощью реакции Гриньяра
Термическое разложение оксалата никеля (II) в отсутствие кислорода:
Восстановление хлорида никеля (II) с помощью дисперсии натрия:
В частности, термолиз оксалата дает мелкодисперсный пирофорный никелевый порошок.
Свойства
Физические свойства
Никель представляет собой серебристо-белый металл, который является одним из тяжелых металлов с плотностью 8,91 г / см3. Он средней твердости (твердость по Моосу 3,8), ковкий, пластичный и очень хорошо полируется. Никель, как железо и кобальт, является ферромагнитным с температурой Кюри 354 ° C. Металл кристаллизуется в кристаллической структуре с кубической гранью (типа меди) в пространственной группе Fm3m (номер пространственной группы 225) с параметром решетки a = 352,4 pm, а также четырьмя формульными единицами на элементарную ячейку. Эта структура сохраняет его даже при высоких давлениях вплоть до как минимум 70 ГПа. Другую метастабильную модификацию с сферической упаковкой с центрированием кубического тела можно получить в тонких слоях на арсениде железа или галлия. Он имеет значительно более низкую температуру Кюри с 183 ° C.
Прочность на растяжение отожженного никеля в 400-450 МПа при удлинении при разрыве между 30 и 45% увеличивается. Значения твердости находятся около 80 HB. Холодно-упрочненный никель, относительное удлинение при разрыве которого ниже 2%, достигает прочности до 750 МПа со значениями твердости около 180 HB. Полуфабрикаты из чистого никеля с содержанием никеля 99% можно упрочнить в холодном состоянии.
Изотоп 62Ni имеет самую высокую энергию связи на нуклон из всех изотопов всех элементов.
Химические свойства
Никель очень устойчив при комнатной температуре к воздуху, воде, соляной кислоте и щелочам. Разбавленные кислоты воздействуют на никель очень медленно. По сравнению с концентрированными окисляющими кислотами (азотной кислотой) пассивация происходит аналогично нержавеющей стали. Никель растворим в разбавленной азотной кислоте (от 10 до 15 процентов). Даже полуконцентрированная азотная кислота (около 30 процентов) вызывает заметную пассивацию. Наиболее распространенным состоянием окисления является + II, реже -I, 0, + I, + III и + IV. В тетракарбониле никеля никель имеет степень окисления 0. Соли никеля (II) растворяются в воде, образуя водные комплексы зеленоватого цвета.
Мелкодисперсный никель реагирует с монооксидом углерода при температуре от 50 до 80 ° C с образованием тетракарбонила никеля, Ni (CO) 4, бесцветной, очень токсичной жидкости. Это служит промежуточным звеном для производства чистого никеля лунным процессом. При температуре от 180 до 200 ° C тетракарбонил никеля разлагается обратно в никель и окись углерода.
Физиология
Спорная сущность никеля контрастирует с существованием нескольких ферментов, которые обычно содержат никель, но не зависят от него, потому что его роль в качестве катиона могут быть приняты другими двухвалентными катионами. У людей эти три белка связывают никель:
альфа-фетопротеин связывает никель, но не зависит от него, так как нет фермента
Acireductone dioxygenase, фермент пути утилизации метионина, который обычно связывает никель или другой двухвалентный катион
Полирибонуклеотид 5'-гидроксикиназа Clp1, для которой в качестве кофактора требуется магний, марганец или никель
Для растений и различных микроорганизмов существенность никеля обусловлена выделением нескольких ферментов (например, уреазы, Co-F430), содержащих никель, в активном сайте, а также обнаружением недостатков в средах с низким содержанием никеля, которые усиливаются добавлением Ni (II) Соли, обеспеченные.
В электрофизиологии ионы никеля используются для блокирования кальциевых каналов, активируемых напряжением.
Проблемы со здоровьем
Никель является наиболее распространенной причиной контактной аллергии на никелевый дерматит: в Германии, по оценкам, от 1,9 до 4,5 миллионов людей повышают чувствительность к никелю. Из-за этого металлы и сплавы, которые вступают в контакт с кожей, становятся все менее никелированными. Около 10% всех детей имеют повышенную чувствительность к никелю. При возобновлении контакта с аллергеном они могут вступать в реакцию с контактной аллергией.
По данным Европейского агентства по безопасности пищевых продуктов (EFSA), допустимое суточное потребление (TDI) никеля составляет 2,8 микрограмм (0.0028 миллиграммов) на килограмм веса тела. 2019 поручил Трудовой палате Верхней Австрии изучить двенадцать различных соевых напитков в Агентстве по охране здоровья и безопасности пищевых продуктов. Значения были между 0,25 (природа соевого напитка Dennree) и 0,69 миллиграммами на литр (да, конечно, органический соевый напиток). В самом высококалорийном соевом молоке килограмм тяжелых детей 30 уже потребил более чем в два раза больше никеля в четверть литра, чем рекомендовано EFSA.
Вдыхание неорганических никелевых соединений связано с повышенным риском развития рака плоскоклеточной карциномы легких и верхних дыхательных путей. Такие злокачественные новообразования признаны профессиональными заболеваниями в Германии после профессионального облучения (BK 4109). Кроме того, повышенное содержание никеля в воздухе и питьевой воде является фактором риска сенсибилизации никеля у детей.
Использование никеля в потребительских товарах (таких как наручные часы, игрушки, пищевое оборудование и т. Д.) Ограничено законодательством Европейского Союза, которое было введено в Германии Постановлением о потребительских товарах, которое устанавливает предельные значения для выпуска.
Использовать
Никель нужен как металл в небольших количествах, большая часть производства идет в производство нержавеющих сталей и никелевых сплавов. Никель используется во многих специфических и узнаваемых промышленных и потребительских товарах, включая нержавеющую сталь, магниты Alnico, монеты, аккумуляторы, струны для электрогитары, капсулы с микрофоном, покрытие для сантехники и специальные сплавы, такие как Permalloy, Elinvar и Invar. Используется для покрытия и в качестве оттенка в стекле. Запасы никелевых месторождений, истощенных с сегодняшней точки зрения, лежат между 70 и 170 миллионами тонн. В настоящее время в мире ежегодно производится более миллиона тонн (2006: 1,340 миллионов тонн). Цена на никель иногда подвержена очень высоким колебаниям цен из-за спекуляций на финансовых рынках.
Около 25 процентов мирового никелевого месторождения находится в Новой Каледонии, французской заморской территории.

Никель-кадмиевая батарея, картинка Википедия
Использовать как металл
Чистый металлический никель используется в тонкоизмельченном виде в качестве катализатора гидрирования ненасыщенных жирных кислот. Из-за своей химической стойкости никель используется для аппаратов в химической лаборатории и химической промышленности (например, никелевые тигли для пищеварения). Из никеля, металла, никелевых сплавов, з. Для монет.

Никелевая проволока
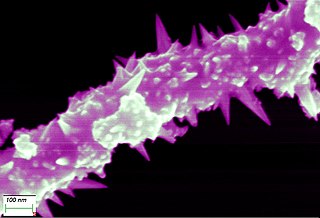
Никелевая проволока 0,01mm при рассмотрении высокопроизводительным микроскопом
Никель служит металлическим покрытием для защиты от коррозии («никелирование») металлических объектов: из-за его окислительно-защитных свойств металлы (в частности, железо) покрываются слоем никеля для определенных технических целей посредством гальванической технологии.
Металл также использовался ранее, чтобы сделать оправы из никелевых очков.
В качестве бета-излучателя изотоп никеля 63Ni используется в детекторах захвата электронов в газовых хроматографах.
Использовать как сплав
Никель - важный легирующий металл, который в основном используется для отделки стали. Большая часть никеля идет туда. Это делает сталь устойчивой к коррозии и увеличивает ее твердость, вязкость и пластичность. Стали с высоким содержанием никеля используются в особо агрессивных средах. Нержавеющая сталь V2A (название происходит от «испытательной партии 2 аустенитной» на сталелитейном заводе Krupp, соответствует X12CrNi18-8) содержит 8% никеля в дополнение к 18% хрома, V4A (торговые марки Cromargan или Nirosta), 11% помимо 18% хрома и 2% молибдена.

Никелевые монеты картинка Википедия
Никель является отличным легирующим агентом для некоторых драгоценных металлов и используется в испытаниях на огнестойкость в качестве коллектора элементов платиновой группы. Таким образом, никель способен полностью собирать все шесть элементов платиновой группы, особенно платину и палладий, из руд и частично собирать золото.
Никелевая пена или никелевая сетка используется в газодиффузионных электродах для щелочных топливных элементов.
Никель и его сплавы часто используются в качестве катализаторов реакций гидрирования. Никель Ренея, тонкоизмельченный никель-алюминиевый сплав, является распространенной формой, хотя также используются соответствующие катализаторы, включая катализаторы типа Ренея.
Около 20% никеля используется (в Германии) для производства других никелевых сплавов:
Konstantan, сплав 55% меди и 45% никеля, который имеет приблизительно постоянное удельное электрическое сопротивление в широком диапазоне температур. В основном используется для точных сопротивлений.
Суперсплавы на основе никеля - это сплавы, специально предназначенные для использования при высоких температурах и в агрессивных средах. Они используются, например, в авиационных турбинах и газовых турбинах электростанций.
Никель Ренея, никель-алюминиевый сплав, который является важным катализатором гидрирования органических соединений.
Никель-серебро, медно-никель-цинковый сплав с содержанием никеля 10-26%, который особенно устойчив к коррозии и в основном используется для столовых приборов и электротехнического оборудования.
Монель, также медно-никелевый сплав с содержанием никеля 65%, меди 33% и железа 2, который характеризуется особой химической стойкостью, включая фтор. Поэтому он используется для газовых баллонов с фтором.
Аустенитный ковкий чугун, специальный сфероидальный чугун с содержанием никеля до 20 для использования в агрессивных средах и при высоких температурах.
доказательство
Реакция обнаружения солей никеля (II), которые обычно растворимы в воде зеленого цвета, проводится гравиметрически и качественно при количественном разделении с раствором диметилглиоксима (реагент Чугаева). Соли никеля предварительно необязательно осаждают сульфидом аммония в виде серо-черного сульфида никеля (II) и растворяют в азотной кислоте. Специфическое обнаружение тогда возможно путем реакции с диметилглиоксимом в аммиачном растворе. Малиновый красный бис (диметилглиоксимато) никель (II) осаждается в виде комплекса:
Поскольку никель количественно осаждается из аммиачного раствора с диметилглиоксимом, это обнаружение также полезно для количественного гравиметрического анализа никеля. Из аммиачного раствора количественное определение также можно сделать с помощью электрогравиметрии на платиновом сетчатом электроде. Подобно другим тяжелым металлам, в настоящее время никель обычно определяют количественно с помощью атомной спектроскопии или масс-спектрометрии также в ультра-следовой области. Чрезвычайно чувствительной является обратная вольтамперометрия с адсорбционным накоплением комплекса Ni-диметиглиоксим на висячих каплях ртути или ртутной пленки.
Связи
Никель встречается в соединениях в основном в степени окисления + II. Уровни 0, + I, + III и + IV редки и обычно нестабильны. Никель образует множество в основном окрашенных комплексов.
Оксид
Оксид никеля (II) и оксид никеля (III) представляют собой твердые вещества зеленого и черного цвета соответственно и используются для изготовления керамики, стекол и электродов. Кроме того, они используются в качестве катализаторов гидрирования органических соединений. Часто, как и многие другие бинарные оксиды металлов, оксид никеля (II) не является стехиометрическим, что означает, что отношение никель-кислород отклоняется от 1: 1. Это свойство сопровождается изменением цвета, когда стехиометрически правильный оксид никеля (II) имеет зеленый цвет, а нестехиометрический оксид никеля (II) - черный. Оксид никеля (III) обладает сильным окислительным действием и неизвестен как чистое вещество.
галогениды
Хлорид никеля (II) представляет собой желтоватое высоко гигроскопичное твердое вещество, которое служит красителем для керамики и для производства никелевых катализаторов. В дополнение к безводной форме, есть еще водные хлориды никеля (II), z. В качестве зеленого гексагидрата хлорида никеля (II), который кристаллизуется из водных растворов хлорида никеля. Безводный хлорид никеля (II) имеет тригональную кристаллическую структуру типа хлорида кадмия (II), имеющую пространственную группу R3m (номер пространственной группы 166). Гексагидрат кристаллизуется в моноклинной кристаллической системе в космической группе C2 / m (космическая группа № 12).
Фторид никеля (II) также обладает высокой гигроскопичностью и образует тетрагональные кристаллы от желтоватого до зеленого. В отличие от многих фторидов, он стабилен на воздухе. Он кристаллизуется в тетрагональной кристаллической системе с пространственной группой P42 / mnm (номер пространственной группы 136). Тетрагидрат кристаллизуется в ромбической кристаллической системе с пространственной группой P21ab (номер космической группы 29, позиция 3).
Другие неорганические соединения никеля
Гидроксид никеля (II) и гидроксид никеля (III) используются для накопления электрической энергии в никель-кадмиевых и других никелевых аккумуляторах.
Нитрат никеля (II) используется в керамической промышленности в качестве коричневого пигмента, для окрашивания в качестве морилки, для электролитического никелирования, для извлечения оксида никеля (II) и для производства чистого каталитического никеля. Нитрат никеля (II) является сильным окислителем и обычно происходит в форме его гексагидрата Ni (NO3) 2 · 6 H2O.
Никель (II) сульфат и аммоний никель (II) сульфат используются в гальванических (никелирование). Сульфат никеля (II) является наиболее технически важным соединением никеля. Он используется для производства других никелевых соединений и катализаторов. Водные растворы сульфата никеля (II) и хлорида никеля (II) используются для электроосаждения слоев металлического никеля. Кроме того, это используется в крашении как протрава и в производстве противогазов.
Карбонат никеля (II) встречается в нескольких гидратных формах. Он используется в качестве катализатора при отверждении жира и для производства оксида никеля (II), керамических красок (пигментов) и глазурей, а также в гальванических покрытиях. Он образовал треугольную кристаллическую систему с пространственной группой R3c (номер пространственной группы 161).
Сульфид никеля (II) осаждается из аммиачных, но не кислых никельсодержащих растворов с сульфидом аммония. В результате никель может быть отделен с сульфидной группой аммония в процессе разделения катионов.
Антимонид никеля является блестящим металлическим минералом и имеет ярко-медный красный цвет. Антимонид никеля используется в качестве материала в пластинах магнитного поля, где он вставлен между магнитно-чувствительными слоями антимонида индия. Пластины магнитного поля изменяют свое электрическое сопротивление в зависимости от плотности магнитного потока и служат датчиком для магнитных полей. Он образует гексагональную кристаллическую структуру в пространственной группе P63 / mmc (номер космической группы 194).
Органические соединения никеля
Никель тетракарбонил Ni (CO) 4 - бесцветная, очень токсичная жидкость. Это важный посредник в лунном процессе. Тетракарбонил никеля был первым металлическим карбонильным соединением
никелевые комплексы
Ионы никеля и особенно никеля (II) образуют множество, в основном окрашенных комплексов. Координационные числа 6, 5 или 4 являются наиболее распространенными. В случае слабых монодентатных лигандов, например воды, они обычно присутствуют в виде октаэдрических и парамагнитных высокоспиновых комплексов с координационным числом 6. Сильные лиганды, такие как цианид, образуют плоско-квадратные диамагнитные низкоспиновые комплексы. Диметилглиоксим также образует плоско-квадратный комплекс, так как комплекс дополнительно стабилизирован водородными связями. Последний комплекс бис (диметилглиоксимато) никеля (II) важен для мокрого химического обнаружения никеля. Анионные комплексы никеля оканчиваются «-николятом».
Примерами комплексов аминов являются синий комплекс тетрааммин никель (II) и фиолетовый комплекс гексааммин никель (II). Оба соединения получают добавлением аммиака к солевым растворам никеля (II):
Добавление цианида калия к солевым растворам никеля (II) первоначально приводит к образованию цианида никеля (II), который растворяется в избытке цианида калия до желтого тетрацианониколата калия (II):
Соответствующее соединение образуется с тиоцианатом калия. Очень чувствительным соединением является гексафторниколат калия (IV) (K2 [NiF6]). Тетрацианониколат калия (II) можно получить из одновалентного никеля с использованием сильного восстановителя K4 [Ni2 (CN) 6]. Кроме того, существует множество комплексов с органическими лигандами, такими как этилендиамин или анионы карбоновых кислот.


![{\ Displaystyle {\ ce {NiC2O4 -> [T] [] Ni + 2 CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f5ac7119d30ce593cf99675097e91e39e33a04d)


![{\ Displaystyle {\ ce {NiSO4 + 4NH4 + + 4OH- -> [Ni (NH3) 4] SO4 + 4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fed711e628c3ba92046eb178a459488074a035c9)
![{\ Displaystyle {\ ce {Ni (CN) 2 + 2KCN -> K2 [Ni (CN) 4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a2b8181f20f5d9ad99c2900689b699739283d0d)
