Висмут, Bi, атомный номер 83
Висмут - история висмута, возникновение, добыча, использование и цены
Висмут или висмут (также устарел: висмут) - это химический элемент с символом элемента Bi и атомным номером 83. В периодической таблице это находится в 5. Основная группа или азотная группа.
Нет известного стабильного изотопа. Однако чрезвычайно низкий период полураспада и чрезвычайно низкая радиоактивность природного 209Bi не имеет значения для практического использования. Радиоактивность могла быть обнаружена только 2003, поскольку ранее необходимые высокочувствительные методы измерения не были доступны; 1990Bi считался самым тяжелым стабильным нуклидом в годы 209.
история
В качестве отдельного элемента висмут стал центром 18. Веками продемонстрировали химики Клод Франсуа Жоффруа, Иоганн Генрих Потт, Карл Вильгельм Шееле и Торберн Улоф Бергман. Ранее его часто рассматривали как производное свинца, олова, сурьмы и других металлов или минералов. В книге Полезная горная книга (о 1527) руда висмута (wissmad arzcz) упоминается как спутник серебряной руды. Позже в 16. Век Георгиус Агрикола попробовал более точное разграничение.
Название металла, которое появляется как wesemut в немецком 1390 и лат. 1450 как wismutum, 1530 как bisemutum, может быть переведено на арабский перевод Хоска Диоскури. Век документированной формы b [i] sīmūtīyūn можно приписать, что само по себе, вероятно, транслитерация древнегреческого representsιμύθιον psimýthion, свинцовый белый 'представляет. Происхождение арабского imid, сурьмы 'было также принято; Нередко, помимо предполагаемого первого мятежа на шахте Св. Георгена на лугах близ Шнееберга в Эрцгебирге в 9. В., или по варианту вис (с) мат. что означает «белая масса».
Химический символ Bi был предложен JJ Berzelius в 1814 году.
Вхождение
Висмут встречается в природе в природе, то есть в элементарной форме, и признан минералом Международной минералогической ассоциацией (IMA). 9 используется IMA. Издание классификации минералов по Карлу Уго Струнцу приводит висмут вместе с сурьмой, мышьяком и стибарсеном в подразделение мышьяковых элементов по системе №. 1.CA.05 (устаревшее издание 8: I / B.01-40). В преимущественно используемой в англоязычной классификации минералы по Дана Висмут относится к «группе мышьяка» с системой №. 01.03.01.
Твердый висмут образуется в гидротермальных жилах пегматитов и топазсодержащих олово-вольфрамовых кварцевых жил и обычно вместе с различными медными, никелевыми, серебряными и оловянными рудами. Висмут редко развивает хорошо сформированные кристаллические формы, но может достигать размера до 12 сантиметров. Он обычно встречается в форме дендритных, фолиевых или зернистых агрегатов, а также в виде полисинтетических близнецов с параллельными полосами («перистый висмут») или воронкообразных боковых поверхностей, втянутых в кристаллический центр.
До сих пор (по состоянию на 2011) вокруг 1400 известны места для твердого висмута. Места в основном находятся в Австралии, Боливии, Китае, Канаде, Мексике, Перу и Испании, исторически в Бибере в Шпессарте и в Рудных горах, где висмут находится как в чистом виде, так и в виде сульфида (висмутит), селенида (селенид висмута, глянец) и оксида ( Бисмит) найден. Кроме того приходит висмут, а также сурьму и мышьяк, иногда в виде двойного сульфида до: Galenobismutit (PbBi2S4) Lillianit (Pb3Bi2S6) Silberbismutglanz (AgBiS2) Kupferbismutglanz (CuBiS2) и Kupferbismutblende (Cu6Bi2S6). Также известен сульфид теллура в форме теллурбизма (Bi2Te2S) и силикат под названием Eulytin (Bi4 (SiO4) 3).
В целом, в том числе твердый висмут вокруг минералов висмута 230 известны.
Извлечение и презентация
Для производства висмута можно предположить оксидные или сульфидные руды.
Оксидные руды превращаются в висмут в угольных печах:
Соли сульфидного висмута могут быть восстановлены с помощью железа методом осаждения:
Или сульфидные руды сначала превращаются в оксиды, а затем восстанавливаются с помощью угля (метод восстановления Рёдера):
Сырой висмут затем удаляется путем окислительного плавления других элементов (сурьмы, мышьяка, свинца, железа и серы). Медь удаляют путем плавления с сульфидом натрия, золотом и серебром путем экстракции расплавленного висмута оловом.
Свойства
Физические свойства
Висмут - это серебристо-белый, хрупкий и грубокристаллический металл или полуметалл с оттенком розового. Он имеет ромбоэдрическую кристаллическую структуру с очень плотно упакованными бислоями. Наименьшее расстояние между двумя двойными слоями равно 352,9 pm, которое на 15% больше, чем наименьшее расстояние между двумя атомами в двойном слое. Монокристаллы висмута демонстрируют выраженное расщепление параллельно этим бислоям.
Висмут обладает самым сильным эффектом Холла из всех металлоподобных элементов и, как полуметалл в чистом виде, обладает низкой электропроводностью. Он показывает - помимо сверхпроводников и пиролитического графита - за пределами самого сильного диамагнитного свойства, он выталкивается из приложенного извне магнитного поля. Эффект Шубникова-де-Хааса (колебания электрического сопротивления во внешнем магнитном поле) впервые был обнаружен на кристаллах висмута и измерен. До разработки датчиков Холла и полевых пластин для измерения магнитных полей использовалась так называемая спираль висмута, катушка с намотанной тонкой изолированной проволокой из висмута. Изменение сопротивления катушки под воздействием изменяющегося магнитного поля было, конечно, очень мало по сравнению с современными датчиками.
Существует две известные модификации висмута: висмут, который является обычным при комнатной температуре, образует кубическую объемно-центрированную кристаллическую структуру под высоким давлением (по данным 9 GPa).
Жидкий висмут расширяется как одно из немногих веществ, когда он затвердевает (аномалия плотности). Это явление также наблюдается в галлии, германии, плутонии, кремнии, теллуре и воде. Это основано на висмуте, что во время плавления (и затвердевания) происходит двойной фазовый переход: после фазового перехода 1. Порядок от твердого к жидкому (обычно с небольшим уменьшением плотности) и, кроме того, фазовый переход 1. Порядок металлоида к металлу со значительным увеличением плотности, что также объясняет необычайно большую энтропию плавления 21,1 J / (K · моль) и внезапное увеличение электропроводности расплава висмута.
Химические свойства
Висмут устойчив к сухому воздуху при нормальной температуре. Однако во влажном воздухе на поверхности образуется оксидный слой. Кроме того, висмут устойчив к воде и неокисляющим кислотам (соляная кислота и разбавленная серная кислота). В окисляющих кислотах (азотной или горячей концентрированной серной кислоте) висмут растворяется с образованием солей висмута (BiX3). В виде порошка это легковоспламеняющееся твердое вещество, которое может легко воспламениться при кратковременном воздействии источника возгорания и продолжает гореть после удаления. Риск воспламенения тем больше, чем тоньше вещество распределяется. Металл в компактном виде не воспламеняется.
Когда раскалено докрасна, висмут горит голубоватым пламенем до коричнево-желтого дыма - оксида висмута (III) (Bi2O3).
Под воздействием тепла висмут соединяется непосредственно с галогенами, а также непосредственно с серой, селеном и теллуром. Висмут не реагирует с азотом и фосфором.
Изотоп
Природный висмут состоит только из изотопа 209Bi. В 2003, Institut d'astrophysique spatiale, Orsay, France, обнаружил, что этот изотоп, стабильный до настоящего времени, является альфа-излучателем с периодом полураспада (1,9 ± 0,2) 1019 лет (приблизительно 19 триллион лет). Очень медленный распад 209Bi в 205Tl основан, с одной стороны, на непосредственной близости к двойному магическому 208Pb в изотопной схеме и на том факте, что сам 209Bi просто магический. Длительный период полураспада приводит к активности 0,0033 Бк / кг (соответствует одному ядерному распаду за пять минут и килограмм).
209Bi является предпоследним членом серии Neptunium и, за исключением 205Tl, единственной, которая все еще естественна. Поскольку в настоящее время в ядерных реакторах инкубируются нуклиды, находящиеся в начале серии Нептуний, количество 209Bi на Земле со временем увеличивается.
Использовать
Висмут используется в качестве компонента сплава в легкоплавких сплавах, например для металла Вуда, который плавится при 70 ° C, для металла Роуза с температурой плавления 98 ° C и для металла Липовица, который плавится при 60 ° C.
Техническое использование
Сплав Бисманол с марганцем является сильным постоянным магнитом.
При покрытии сплавов (горячее лужение) для солнечных разъемов он служит заменой свинца.
Монокристаллы синтетического висмута с размерами более сантиметров 20 и поликристаллические пластины из висмута используются в качестве нейтронных фильтров при исследовании материалов исследовательских реакторов.
Химическое соединение теллурида висмута перекачивает тепловую энергию в элементы Пельтье.
Материал с изменением фазы некоторых DVD-RAM содержит висмут, см. Технология изменения фазы.
Висмут распространяется некоторыми источниками в качестве легирующего элемента в свободно режущих сталях для замены свинца. Это должно улучшить обрабатываемость этих сталей без отрицательных экологических свойств свинца. Однако с точки зрения металлургии стали это неблагоприятно, поскольку висмут практически не может быть удален металлургически, а затем появляется в качестве нежелательного сопутствующего элемента в сталях, получаемых из лома. В электронной промышленности в качестве заменителя этилированных припоев используется сплав олова и висмута (ключевое слово RoHS). Недостатком является то, что для висмутовой олова требуется собственное паяльное оборудование. Загрязнение свинцом (например, ремонт старого оборудования) приводит к очень низкой температуре плавления, в то время как использование инструментов из сплава олова и серебра приводит к высоким температурам и загрязнению висмутового инструмента.
Оксид висмута используется для производства оптических стекол, а также для спекания технической керамики. Он также находит применение в форме германата висмута в качестве сцинтилляционного детектора в позитронно-эмиссионной томографии (ПЭТ).
Свинцово-висмутовый сплав использовался в Советском Союзе в качестве теплоносителя для ядерных реакторов. Хотя этот сплав более эффективен, чем обычное водяное охлаждение под давлением, с ним также сложнее обращаться. Сплав затвердевает при температуре ниже 125 ° C и может привести к серьезному повреждению реактора. Такие реакторы использовались, в частности, на атомных подводных лодках (например, подводная лодка класса «Альфа»).
Висмут также используется в качестве нетоксичного свинцового заменителя боеприпасов для дробовика. Однако это не очень распространено.
В 16. Век был разработан на юге Германии и Швейцарии в технике живописи, в которой висмут использовался в качестве покрытия для небольших декоративных коробок или коробок, в частности, также для деревянных алтарей. Эта техника называется росписью висмутом.
Использование в химической промышленности
Оксид хлорида висмута (BiOCl) используется в косметике в качестве серебристо-белого перламутрового пигмента.
Ванадат висмута используется в качестве очень стойкого к атмосферным воздействиям зеленовато-желтого пигмента и находит з. B. в высококачественных красках, эмульсионных красках для фасадов, пластике и печатных красках.
Кроме того, висмут используется в качестве катализатора в химической промышленности.
Лекарственное использование
Соединения висмута, такие как дибисмут трис (тетраоксодиалюминат), нитрат висмута (субнитрат висмута, основной нитрат висмута), используются в качестве части антибактериальной терапии против возбудителя Helicobacter pylori, которая может вызывать язву желудка и двенадцатиперстной кишки (эрадикационная терапия). Приложение представляет собой так называемую четырехкратную терапию (комбинированная терапия ингибитором протонного насоса и тройная терапия висмутом [соль висмута, тетрациклин, метронидазол).
Соединения висмута также частично используются при диарее в качестве вяжущих и уменьшающих запах при неприятном запахе изо рта и метеоризме. Кроме того, некоторые соединения (например, биброкатол) используются в качестве антисептика.
Кроме того, висмут используется для диагностики в позитронно-эмиссионной томографии в виде германата висмута в качестве детекторного материала томографического аппарата.
Исторически висмут был в конце 19. В. как часть раневых порошков (например, дерматол). Начиная с 1920 лет, он использовался как средство от сифилиса. Тем не менее, он был полностью заменен современными антибиотиками.
Соли висмута также использовались в качестве рентгеноконтрастных агентов для визуализации желудочно-кишечного тракта (так называемая мука висмута). Здесь соль висмута была заменена сульфатом бария.
Галлат висмута используется в составе бальзама для кожи Stolte, а мазь может использоваться для лечения воспалительной кожи у младенцев.
Vergiftung
Отравление висмутом (висмутизм) встречается редко из-за плохой абсорбции в желудочно-кишечном тракте. Это в значительной степени похоже на отравление ртутью. Типичным является появление висмута серовато-серого висмута (отложение сульфида висмута) на слизистой оболочке полости рта с образованием слизистой оболочки полости рта (стоматит) и гингивита (с ослаблением, потерей зубов), кишечного энтерита с диареей и повреждением почек (нефропатия висмута).
доказательство
Висмут обнаруживается по желобу висмута с тиомочевиной. Фторид натрия, хлорид натрия и тартрат калия натрия используются для осаждения нежелательных мешающих ионов:
NaF для комплексообразования Fe3 + и Al3 +
NaCl для осаждения Ag + и Hg22 +
Тартрат для комплексообразования Sb3 + и Sn2 +
В присутствии Bi3 + образуется кристаллический лимонно-желтый комплекс тиомочевины, в котором три молекулы тиомочевины связаны с висмутом через серу:
![{\displaystyle {\ce {\rm {Bi^{3+}{+}3SCN2H4{->}[Bi(SCN2H4)3]^{3+}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c283de06adc520701a39cebdb2d9f9e206572f68)
Альтернативные реакции обнаружения:
В окислительно-восстановительной реакции с ионами олова (II) в качестве восстановителя элементный висмут осаждает черный цвет.
С раствором йодида натрия: сначала выделяется йодид черного висмута (III), который затем растворяется в избытке йодида в виде оранжевого тетраиодобисмутатного комплекса:
![{\ displaystyle {\ ce {\ rm {Bi ^ {3 +} {+} 4I ^ {-} {->} [BiI4] ^ {-}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f1a3e20448941130afb1ebcb56f6ed3bd093dad)
1,3,4-тиадиазол-2,5-дитиол также подходит в качестве комплексообразующего агента для обнаружения.
Связи
Висмут в основном трехвалентный, но есть также один и пятивалентный висмут; Однако оксид висмута (V) является очень сильным окислителем, который даже окисляет марганец (II) до перманганата. Он также образует полимерные катионы. Он стабилен в воздухе.
- кислородные соединения
Оксид висмута (III) (висмут, также называемый стулом висмута) - соединения серы
Висмут (III) сульфид - Водородные соединения
Висмут водород (висмутан) - Галогениды и нитраты
Фториды: фторид висмута (III), фторид висмута (V), фторид оксида висмута
Хлориды: субхлорид висмута, хлорид висмута (III), оксид хлорида висмута
Бромиды: суббромид висмута, бромид висмута (III), бромид оксида висмута
Йодиды: йодид висмута (I), йодид висмута (III), йодид оксида висмута
Нитраты: нитрат оксида висмута (субнитрат висмута) - Как анион
висмутат натрия (V),
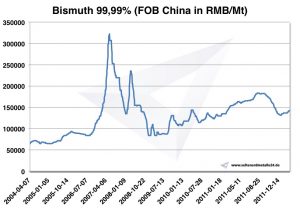
Диаграмма Висмут 2004 2011



