Хром, Cr, атомный номер 24
Хром - Извлечение хрома, использование, цены
общий
Хром (alt. Χρῶμα chrṓma, color ') представляет собой химический элемент с символом элемента Cr и атомным номером 24. Он относится к переходным металлам, в периодической таблице он находится в 6. Подгруппа (группа 6) или хромовая группа. Соединения хрома имеют много разных цветов и часто используются в качестве пигментов в красках и лаках.
восстановление
Добытая хромитовая руда освобождается от пустой породы. На втором этапе происходит окислительное разложение при температуре около 1200 ° C с получением хромата:
Хромат натрия экстрагируют горячей водой и с помощью серной кислоты превращают в дихромат:
Дихромат натрия кристаллизуется при охлаждении в виде дигидрата из раствора. Последующее восстановление углеродом дает оксид хрома (III):
Затем следует алюмотермическое восстановление оксида хрома (III) до хрома:
Хром нельзя получить из оксидных руд восстановлением углем, так как при этом образуется карбид хрома. Более чистый хром получается путем электроосаждения Cr3+Ионы из раствора серной кислоты показаны. Соответствующие растворы готовят растворением оксида хрома (III) или феррохрома в серной кислоте. Однако феррохром в качестве исходного материала требует предварительного отделения железа.
Чрезвычайно чистый хром получается путем дополнительных стадий очистки с использованием процесса Ван-Аркеля-де-Бура.
Феррохром получают восстановлением хромита в дуговой электропечи при 2800 ° C.
Свойства
Хром - это серебристо-белый твердый металл, устойчивый к коррозии и потускнению, который в своем первоначальном состоянии является жестким, пластичным и пластичным. Это антиферромагнетик с температурой Нееля 475 К.[11] Хром растворяется в соляной кислоте и серной кислоте через некоторое время с выделением водорода, когда защитный оксидный слой исчезает. Обычные уровни окисления хрома +2, +3 и +6, причем +3 является наиболее стойким.
Cr (II) является4-Нестабильная конфигурация. Вряд ли найдется другой восстановитель, который так быстро поглощает кислород из воздуха, как Cr (II). Но даже без доступа воздуха Cr2+-Решения являются стабильными только в течение короткого времени, если они получены из чистейшего хрома (например, электролитного хрома).
Cr3+ самая устойчивая форма. Это объясняется теорией кристаллического поля, согласно которой d3 Конфигурация стабилизируется наполовину заполненной нижней оболочкой.
Cr (VI) в виде хромата (CrO42-) или дихромат (Cr2O72-) используется как сильный окислитель. Он токсичен и канцероген. В водных растворах между двумя ионами существует химическое равновесие, которое зависит от pH. Если вы подкислите разбавленный раствор желтого хромата, вы получите H.+-Ионы, по Ле-Шателье, равновесие смещается в сторону дихромата, раствор становится оранжевым.

- Инструкции по технике безопасности и биологическое значение
Роль Cr (III) (Cr3+Ионы) в организме человека в настоящее время является предметом споров. Есть указания на то, что Cr (III) может играть роль в метаболизме углеводов и жиров у млекопитающих. Эта информация в настоящее время проверяется. Ранее данные о том, что популярная пищевая добавка Cr (III) -пиколинат оказывает благотворное влияние на структуру тела, не могли быть подтверждены в более поздних исследованиях. Исследование с клетками хомяка показало, что пиколинат Cr (III) является мутагенным и может вызывать рак.
Имеющиеся в настоящее время данные показывают, что крайне маловероятно, что он будет страдать от дефицита хрома. Даже более высокие дозы Cr (III) с трудом вызывают токсический эффект, поскольку произведение растворимости гидроксида Cr (III) чрезвычайно низкое (6,7 × 10-31). Поэтому, вероятно, очень трудно всасываться в кишечнике человека. В США рекомендуемый уровень потребления Cr (III) был снижен с 50–200 мкг / день до 35 мкг / день для взрослых мужчин и до 25 мкг / день для взрослых женщин.
Соединения Cr (VI) чрезвычайно токсичны. Они мутагены и повреждают ДНК. Они попадают в организм через дыхательные пути и повреждают легочную ткань. Люди, хронически подвергающиеся воздействию таких соединений, подвергаются повышенному риску развития рака легких. Ядовитый эффект усиливается при нерастворимости соли. Директива RoHS строго ограничивает использование соединений Cr (VI) в Европе.
Использовать
Хром и соединения хрома используются в самых разных областях, где используется его долговечность:
- твердое хромирование: гальваническое нанесение износостойкого слоя толщиной до 1 мм непосредственно на сталь, чугун, медь. Алюминий также можно хромировать после нанесения промежуточного слоя (алюминиевые цилиндры с твердым хромированием в конструкции двигателя).
- Dekorverchromung: гальваническое нанесение слоя Cr толщиной <1 мкм в качестве украшения с промежуточным антикоррозийным слоем из никеля или никель-медь. Пластиковые детали тоже очень часто хромируют. Процесс ахролита заменяет декоративное хромирование.
- пассивация гальванически цинковые слои (хромирование)
- легирующий элемент: в коррозионно-стойких и жаропрочных нержавеющих сталях и цветных сплавах
- Катализатор: включить или ускорить химические реакции
- хром дубления: основной метод изготовления кожи
Связи
- Окись хрома
- Оксид хрома (III) Cr2O3, используется в качестве эмалевой краски и для окраски стекла (зеленые бутылки) (также Кельнский мост в зеленый цвет). Его не следует путать с токсичным зеленым хромом.
- хром желтый
- Хромат свинца (II) PbCrO4, раньше использовался как пигмент ярко-желтого цвета («Постгельб»). Из-за своей токсичности в настоящее время он почти полностью заменен органическими цветными пигментами. В анализе он используется для йодометрического определения свинца.
Желтый хром, который используется в качестве краски для художников, представляет собой сульфат свинца / хромат свинца (около 2 PbSO4 · PbCrO4). Пигмент был открыт Луи-Николя Воклен в 1809 году и коммерчески производился в Германии с 1820 года. Желтый хром имеет высокую укрывистость, его светостойкость зависит от желтого тона. Желтый хром редко используется в масляной живописи. Винсент Ван Гог, однако, использовал желтый хром а. а. в знаменитых картинах подсолнечника, выполненных маслом на холсте. Однако сегодня некоторые из них страдают обесцвечиванием желтых тонов.
Художественный технолог профессор Кристоф Крекель из Штутгартской художественной академии об использовании пигмента хром желтый: «Художники упали на хромово-желтый, потому что это очень блестящий желтый - он обладает большой интенсивностью цвета, то есть вы можете создать гораздо более яркую картину с помощью этого нового желтого оттенка».
Хром желтый также является важным цветом в анализе подделок «старых» картин.
- двуокись хрома
- Оксид хрома (IV) CrO2, представляет собой черный ферромагнитный порошок для производства магнитных лент с лучшим отношением сигнал / шум, чем обычные магнитные ленты из оксида железа, поскольку диоксид хрома имеет более высокую коэрцитивную силу.
- хромовая кислота
- с гипотетической структурой H2CrO4 существует только в разбавленном водном растворе. Это очень ядовито. Он существует в виде аниона в некоторых хроматах и дихроматах.
Ангидрид хромовой кислоты, очень ядовитый оксид хрома (VI) CrO3, известен как триоксид хрома.
Оранжевый, очень ядовитый дихромат калия K2Cr2O7 является мощным окислителем: в растворе серной кислоты первичные спирты легко превращаются в соответствующие альдегиды, которые можно использовать для полуколичественного определения алкоголя в выдыхаемом воздухе. В лабораторной зоне это было в виде хромовая кислота используется для чистки посуды. Однако при контакте с хлорид-ионами летучие, канцерогенные хромилхлорид CrO2Cl2 сформировано (удержание!). Дихромат калия также используется в качестве титранта и фиксатора в промышленных красильных ваннах. Дихромат калия, а также очень ядовитый дихромат аммония (NH4)2Cr2O7 являются светочувствительным веществом в слоях хрома-желатина в ранних фотографиях (см. процесс тонкой печати).
- хромит
- (Хромированный железный кирпич, см. Выше) FeCr2O4 используется для изготовления форм для сжигания кирпича.
Цены на хром, графики и исторические данные
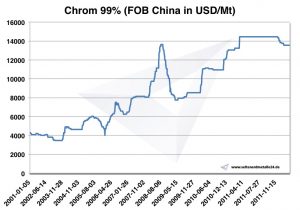
Диаграмма Chrome 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


