Германий, Ge, атомный номер 32
Германий цена, возникновение, добыча, использование
Германий (от латинского Germania «Германия», после страны, в которой он был впервые найден) является химическим элементом с символом Ge и атомным номером 32. В периодической таблице это находится в 4. Период и в 4. Основная группа (14, группа IUPAC, р-блок и группа углерода). Это было на 6. Февраль 1886 впервые обнаружен в минеральном аргиродите.
история
Когда Xnumx Дмитрий Менделеев разработал периодическую таблицу, он обнаружил зазор под кремнием и постулировал до сих пор неизвестный элемент, который он назвал Eka Silicon. Менделеев сделал предсказания о свойствах эка-кремния и его соединений, которые, однако, были отвергнуты наукой.
1885 обнаружил, что Клеменс Уинклер (1838-1904), химик из Bergakademie Freiberg, работая с недавно обнаруженным минералом аргиродитом, показал, что его количественный анализ всегда приводил к дефициту около семи процентов. Как только анализ повторялся, дефицит оставался примерно постоянным, и Винклер, наконец, догадывался, что минерал содержал до сих пор неизвестный элемент. После четырех месяцев работы он наконец преуспел в 6. Февраль 1886 - выделение белого сульфидного осадка, который может быть восстановлен в потоке водорода до металлического порошка. Следуя ранее обнаруженной планете Нептун, Винклер изначально хотел назвать новый элемент Нептуний. Поскольку это имя уже использовалось для другого подозреваемого элемента, он назвал его в честь открытия Германий. Сначала Винклер предположил, что германий - это скибий Эка, постулированный Менделеевым, а Менделеев изначально хотел классифицировать его как Эка-кадмий, а не Эка-кремний. После того, как были определены дополнительные свойства, было подтверждено, что это, вероятно, предсказанный элемент Eka-кремний. Менделеев получил свои свойства из своей периодической таблицы, так что эта находка способствовала распознаванию периодической таблицы:
Происхождение и этимология названия германия также может быть вызвана семантическим недоразумением в связи с его предшественником - галлием, потому что существует две теории именования галлия. После первого, французский химик Поль Эмиль Лекок де Буабодран назвал этот элемент в честь Галлии, латинского имени его родной Франции. Вторым является также латинское слово gallus (петух) в качестве источника названия, что означает le coq («петух») на французском языке. Пол Эмиль Лекок де Буабодран назвал бы новый элемент в честь своего имени. Винклер предположил, что предыдущий элемент Галлий был назван в честь национальности французского исследователя. Поэтому он назвал новый химический элемент "Германий" в честь своей страны (Латинская Германия для Германии).
Вхождение
Германий широко распространен, но встречается только в очень низких концентрациях; Значение Кларка (= среднее содержание в земной коре): 1,5 г / т. В природе он обычно встречается в виде сульфида (тиогерманата) и часто встречается в качестве компаньона в медных и цинковых рудах (медный сланец Мансфельда). Самые важные минералы аргиродит 

Добыча и производство
Согласно USGS, годовой объем производства 2014 оценивался в 165 т, из которых 120 т было в Китае. Цена за 1 кг Германий была 2014 около 1.900 USD. Согласно ЕС, цена 2003 была 300 USD / кг, а 2009 выросла до 1.000 USD.
Для представления германия, в частности дымовых газов (содержат оксид гемания ( 

Свойства
элементный германий
Германий входит в периодическую таблицу в серии полуметаллов, но по недавнему определению классифицируется как полупроводник. Элементарный германий очень хрупок и очень стабилен на воздухе при комнатной температуре. Он окисляется до оксида германия (IV) (GeO2) только после сильного отжига в атмосфере кислорода. GeO2 является диморфным и превращается при 1033 ° C путем модификации рутила (CN = 6) в структуру ß-кварца (CN = 4). В виде порошка это легковоспламеняющееся твердое вещество, которое легко воспламеняется при кратковременном воздействии источника возгорания и продолжает гореть после удаления. Риск воспламенения тем больше, чем тоньше вещество распределяется. В компактном виде он не воспламеняется. Германий является двухвалентным и четырехвалентным. Соединения германия (IV) являются наиболее стабильными. Из соляной кислоты, раствора гидроксида калия и разбавленной серной кислоты германий не подвергается нападению. Однако в щелочных растворах перекиси водорода, концентрированной горячей серной кислоте и концентрированной азотной кислоте он растворяется с образованием гидрата диоксида германия. Согласно его положению в периодической таблице, его химические свойства находятся между кремнием и оловом.
Германий является одним из немногих веществ, обладающих аномалией плотности. Его плотность ниже в твердом состоянии, чем в жидком состоянии. Его ширина запрещенной зоны составляет около 0,67 эВ при комнатной температуре.
Германиевые пластины значительно более хрупкие, чем кремниевые пластины.
Использовать
электроника
Как полупроводник, германий в форме монокристалла был ведущим материалом в центре электроники 20. Специально для производства первых германиевых диодов и биполярных транзисторов, доступных на рынке, пока он не был вытеснен кремнием в этих областях. Сегодня применяются в высокочастотной технологии (например, в качестве полупроводника на основе соединения германия и кремния) и в технологии детекторов (например, в качестве детектора рентгеновских лучей). Солнечные элементы арсенида галлия (GaAs) иногда изготавливают из пластин германия. Константа решетки германия очень похожа на решетку арсенида галлия, так что GaAs эпитаксиально растет на монокристаллах германия.
Очки и волокна
Второе его основное применение - в области инфракрасной оптики в виде окон и линзовых систем из поликристаллического или монокристаллического германия и оптических стекол с пропусканием инфракрасного излучения, так называемых халькогенидных стекол. Приложения включают в себя военные и гражданские приборы ночного видения, а также тепловизионные камеры.
Другие основные области применения - производство оптических и полиэфирных волокон. В современных стеклянных волокнах для телекоммуникаций тетрахлорид германия используется при химическом осаждении из паровой фазы с целью образования диоксида германия во внутренней сердцевине волокна. Это приводит к более высокому показателю преломления в сердечнике по сравнению с оболочкой из волокна, благодаря чему обеспечивается направление световых волн. В химии полиэфира диоксид германия используется в качестве катализатора при производстве определенных полиэфирных волокон и гранулятов, особенно для бутылок из ПЭТ, пригодных для переработки (ПЭТ = полиэтилентерефталат).
Ядерная медицина и ядерные технологии
68Ge используется в генераторе галлия 68 в качестве исходного нуклида для производства галлия-68. Точно так же 68Ge используется в качестве источника для калибровки детектора в позитронно-эмиссионной томографии.
В качестве высокочистого монокристалла германия используется детектор излучения.
Германий в пищевых добавках
Вещество Bi (карбоксиэтил) германий сесквиоксид (Ge-132) рекламировалось как диетическая добавка для применения при ряде заболеваний, включая рак, синдром хронической усталости, иммунодефицит, СПИД, гипертонию, артрит и пищевую аллергию. Положительные эффекты на течение болезни еще не были научно доказаны.
В соответствии с европейской директивой 2002 / 46 / EC о сближении законов государств-членов, касающихся пищевых добавок, германий не следует использовать в пищевых добавках. Поэтому во многих странах ЕС, которые уже согласовали свое национальное законодательство, в том числе в Германии и Австрии, добавление германия в качестве минерального источника в пищевые добавки не допускается.
Компетентные органы прямо предупреждают о потреблении Ge-132, поскольку нельзя исключать серьезные последствия для здоровья и смерти.
Лекарственное использование германия
Терапевтическая эффективность противоопухолевого вещества спирогермания при раке не была продемонстрирована. Одобренных готовых лекарственных препаратов с активным ингредиентом спирогермания не существует. В Германии германийсодержащие фармацевтические препараты (составы), кроме гомеопатических разведений от D4, считаются сомнительными. Поэтому их изготовление и доставка запрещены. Германий металлик выпускается в форме гомеопатических лекарств. В составе гомеопатических препаратов описан дикалиевый германий цитрат лактат.
Физиология
Германий и его соединения обладают относительно низкой токсичностью. Следы германия включены в следующие продукты: бобы, томатный сок, устрицы, тунец и чеснок. Это не является важным микроэлементом в соответствии с уровнем техники. Для германия неизвестна биологическая функция. Обсуждается возможное влияние на углеводный обмен. Нет известных заболеваний дефицита германия.
токсичность
В прошлом отравление германием у человека происходило только после приема неорганических соединений германия в качестве пищевой добавки. Первыми симптомами являются потеря аппетита, потеря веса, усталость и мышечная слабость. Это сопровождается неисправностью почек, вплоть до почечной недостаточности, которая может быть смертельной для пациента. Периферическая невропатия как следствие заболевания также сообщается.
Сообщается о временных нейротоксических побочных эффектах при приеме спирогермания в клинических испытаниях. Спиро-германий был протестирован как цитостатик в годы 1980. Данные исследований здоровых добровольцев отсутствуют.
Из экспериментов на животных известно, что германий обладает низкой острой пероральной токсичностью. Симптомы острого отравления большими дозами соединений германия включают в себя:
- Расширение кровеносных сосудов (артэктазия)
- Птоз
- цианоз
- Тремор
Наконец, паралич дыхания приводит к гибели экспериментальных животных. Симптомами хронического или субхронического отравления неорганическими соединениями германия являются:
- Gewichtsverlust
- Органные изменения (масса органов)
- Прогрессирующая невропатия
- повреждение почек
Органические соединения германия показали меньшую токсичность, но привели экспериментальных животных к потере веса и уменьшению количества эритроцитов. Есть только ограниченные данные о тератогенных эффектах германия. Германат натрия был испытан на крысах как неканцерогенный.
Механизм токсичности германия еще полностью не изучен. Однако специфических патологических воздействий на митохондрии почек и нервных клеток не наблюдалось.
взаимодействия
Также обсуждается, может ли германий проявлять взаимодействия с кремнием при метаболизме костей. Он может блокировать действие диуретиков и снижать активность ряда ферментов, таких как дегидрогеназы. В экспериментах на животных у мышей наблюдается увеличение продолжительности сна, вызванного гексабарбиталом, при дополнительной обработке соединениями германия. Это говорит о том, что активность цитохрома P450 также ограничена. Имеются сообщения об органических соединениях германия, блокирующих фермент детоксикации глутатион-S-трансферазу.
Биодоступность и обмен веществ
Германий легко усваивается организмом при приеме внутрь. Он распределяется по всей ткани тела, особенно в почках и щитовидной железе. В отличие от неорганических соединений германия, органогерманы не накапливаются в организме человека. Однако есть только несколько исследований метаболизма германия.
По существу он выводится с мочой. Выведение через желчь и кал также имеет место.
Связи
Германий образует Ge (II) - у. более стабильные соединения Ge (IV), только немногие имеют техническое значение.
Из галогенидов германия есть также Ge (II) - u. Представитель Ge (IV) известен. Четыреххлористый германий (GeCl4), жидкость с температурой кипения 83 ° C, образуется при воздействии хлористого водорода на оксиды германия и является важным промежуточным соединением при извлечении германия. Высокочистый GeCl4 используется при производстве оптических волокон из кварцевого стекла для получения слоя оксида германия (IV) высокой чистоты на внутренней стороне кварцевых волокон. Для получения высокочистых слоев германия также можно использовать диспропорционирование йодида германия (II) с образованием йодида германия и германия (IV):
Германаты представляют собой соединения германия, полученные из его оксида. Почти во всех германийсодержащих минералах германий присутствует в виде германата.
Немцы называются водородными соединениями германия, которые образуют гомологический ряд различных длинноцепочечных молекул. Моногерман или гидрид германия (GeH4) - это газ, используемый в полупроводниковой промышленности для эпитаксии и легирования.
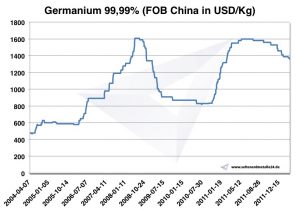
Диаграмма германия 2004-2011

