Индий, В, атомный номер 49
Индий цена, возникновение, добыча и использование
Общий
Индий представляет собой химический элемент с символом In и атомным номером 49. В периодической таблице элементов он находится в 5-м периоде и является четвертым элементом 3-й основной группы (группа 13 по новому счету) или группы бора. Индий - редкий серебристо-белый мягкий тяжелый металл. Его содержание в земной коре сопоставимо с содержанием серебра. Индий не важен для человеческого организма, и о каких-либо токсических эффектах не известно. Большая часть металла теперь перерабатывается в оксид индия и олова, который используется в качестве прозрачного проводника для плоских экранов и сенсорных экранов. С начала тысячелетия связанный с этим повышенный спрос привел к значительному росту цен на индий и к дискуссиям о диапазоне месторождений.
Индий был открыт в 1863 году немецкими химиками Фердинандом Райхом и Теодором Рихтером в Bergakademie Freiberg. Они исследовали образец сфалерита, найденный в этом районе, на предмет таллия. Вместо ожидаемых линий таллия они обнаружили ранее неизвестную спектральную линию синего цвета индиго и, таким образом, ранее неизвестный элемент в спектре поглощения. Позднее новый элемент был назван в честь этого. Спустя короткое время они сначала смогли получить хлорид и оксид индия, а также металл путем восстановления оксида индия водородом. Большое количество индия было впервые показано на Всемирной выставке в Париже в 1867 году.
После его первого использования в 1933 году в качестве компонента сплава для стоматологического золота, широкое использование индия началось во время Второй мировой войны. Соединенные Штаты использовали его в качестве покрытия для подшипников самолетов, подвергающихся высоким нагрузкам. После Второй мировой войны индий в основном использовался в электронной промышленности в качестве припоя и в легкоплавких сплавах. Использование в регулирующих стержнях ядерных реакторов также стало важным с ростом использования ядерной энергии. Это привело к первому резкому росту цен на индий к 1980 году. Однако после аварии на реакторе «Три-Майл-Айленд» спрос и цена значительно упали.
С 1987 года были разработаны два новых соединения индия: полупроводниковый фосфид индия и прозрачный оксид индия-олова, который является проводящим и прозрачным в тонких слоях. Оксид индия и олова, в частности, стал технически интересным с развитием жидкокристаллических экранов. Из-за высокого спроса с 1992 года большая часть индия перерабатывается в оксид индия и олова.
Вхождение
Индий - редкий элемент, его доля в континентальной коре составляет всего 0,05 г / т. Таким образом, он имеет такую же частоту, как серебро и ртуть. В твердом состоянии индий был обнаружен только в одной находке в Восточной Сибири. Известны лишь некоторые минералы индия. В основном это сульфидные минералы, такие как Indit FeIn.2S4 и Roquésit CuInS2. Однако они редки и не играют роли в извлечении индия. Самые большие месторождения индия находятся в цинковых рудах, особенно в сфалерите. Теоретические запасы оцениваются в 16.000 11.000 тонн, из которых около XNUMX XNUMX тонн являются экономически извлекаемыми. Самые крупные месторождения находятся в Канаде, Китае и Перу. Руды, содержащие индий, также встречаются в Австралии, Боливии, Бразилии, Японии, России, Южной Африке, США, Афганистане и некоторых странах Европы. В Германии есть месторождения в Рудных горах (Фрайберг, Мариенберг, Гейер) и на Раммельсберге в горах Гарц.
Извлечение и презентация
Индий получают почти исключительно как побочный продукт при производстве цинка или свинца. Экономичное извлечение возможно, если индий накапливается в определенных точках производственного процесса. К ним относятся дымовая пыль, которая образуется во время обжига сульфида цинка, и остатки, которые остаются во время электролиза во время мокрого процесса производства цинка. Они реагируют с серной кислотой или соляной кислотой и, таким образом, переводятся в раствор. Поскольку концентрация индия в кислоте слишком мала, ее необходимо обогащать. Это осуществляется, например, экстракцией трибутилфосфатом или осаждением в виде фосфата индия.
Фактическое производство индия происходит электролитическим способом. Для этого используется раствор хлорида индия (III) в соляной кислоте. С помощью ртутных электродов он превращается в элементарный индий. Во время электролиза необходимо следить за тем, чтобы раствор больше не содержал таллия, так как стандартные потенциалы двух элементов очень похожи.

Используя подходящие процессы, такие как процессы зонной плавки или повторный электролиз расплавов хлоридных солей индия (I), неочищенный продукт можно дополнительно очистить и, таким образом, можно получить индий с чистотой более 99,99%.
Производство
Первичное производство (добыча руды) индия было между 2006 в году 500 и 580 тонн. Из-за низких природных запасов (11.000 2008 тонн) и высокого спроса индий является одним из самых дефицитных видов сырья на Земле. В 280 году, особенно по Китаю, информация о природных запасах индия выросла с 8.000 до 6 тонн, что расширило статический диапазон с 19 до 2008 лет. Вторичное производство, то есть переработка, превышает первичное производство и составило 800 тонн в XNUMX году.
Производство индия в Китае только недавно увеличилось. В 1994 году произведено 10 тонн. С тех пор доля Китая в мировом производстве увеличилась до 60% в 2005 году. Производство в других странах, таких как Япония, Канада или Франция, могло быть увеличено лишь в незначительной степени или уменьшено из-за истощения запасов. Например, в 2006 году японская шахта Тоёха была закрыта, что привело к значительному сокращению добычи на ней.
Поскольку спрос на индий рос быстрее, чем производство, цена на индий резко выросла с 97 долларов в 2002 году до 827 долларов за килограмм в 2005 году. Индий перерабатывается, в основном, путем переработки остатков от распыления. Единственная страна, в настоящее время добывающая индий в больших количествах, - Япония.
Если спрос продолжит расти, а цена будет расти, переработка материалов с небольшим количеством индия станет выгодной. Кроме того, экономически целесообразно использовать руды с более низким содержанием индия. Это, вероятно, позволит задержать высыхание ресурсов.
Индий можно заменить другими веществами в большинстве случаев, но это часто ухудшает свойства продукта или рентабельность производства. Например, фосфид индия можно заменить арсенидом галлия, а также возможны некоторые заменители оксида индия и олова, хотя и более низкого качества.
Свойства
Физические свойства
| сингонии | четырехугольный |
| Пространственная группа |  |
| параметры решетки
(Элементарная ячейка) |
a знак равноb) = 325 пм
c = 495 вечера |
| Номер (Z) из
формула единицы |
Z = 2 |

Элементарная ячейка индия с координационной средой центрального атома индия

Координационный полиэдр атома индия с 4 + 8 = 12 соседними атомами в виде искаженного кубооктаэдра
Индий - серебристо-белый металл с низкой температурой плавления 156,5985 ° C. Из металлов только ртуть, галлий и большинство щелочных металлов имеют более низкую температуру плавления. Металл является жидким в очень большом диапазоне почти 2000 К. Жидкий индий постоянно оставляет на стекле тонкую пленку (смачивание). Подобный галлий обладает таким же свойством.
Металл обладает высокой пластичностью и очень низкой твердостью (твердость по Моосу: 1,2). Поэтому индий можно резать ножом, как натрий. В то же время он оставляет видимую полосу на бумаге. Индий является сверхпроводником ниже температуры перехода 3,41 Кельвина. Общей с оловом особенностью индия являются характерные шумы, которые можно услышать, когда индий сгибают («оловянные крики»).
Известна только одна кристаллическая модификация индия при нормальных условиях, а именно в тетрагональной кристаллической системе в пространственной группе  и, таким образом, в тетрагональной объемно-центрированной сетке с параметрами сетки a = 325 часов и c = 495 пм и в элементарной ячейке кристаллизуются две формульные единицы.
и, таким образом, в тетрагональной объемно-центрированной сетке с параметрами сетки a = 325 часов и c = 495 пм и в элементарной ячейке кристаллизуются две формульные единицы.
Атом индия окружен двенадцатью другими атомами в кристаллической структуре, четыре из которых происходят из соседних элементарных ячеек и расположены ближе друг к другу (325 пм; красные связи), чем восемь атомов по углам элементарной ячейки (337 пм; зеленые связи). Координационное число 4 + 8 = 12 приводит к искаженному кубооктаэдру в качестве координационного полиэдра. Таким образом, кристаллическую структуру можно описать как тетрагонально искаженную кубическую плотнейшую упаковку сфер.
Дальнейшая модификация была обнаружена в экспериментах при высоком давлении, которая стабильна выше 45 ГПа и в орторомбической кристаллической системе в пространственной группе Fmmm кристаллизуется.
Химические свойства
Химические свойства индия аналогичны свойствам его соседей по группе галлия и таллия. Как и два других элемента, индий является основным элементом, который может реагировать со многими неметаллами при высоких температурах. На воздухе он стабилен при комнатной температуре, потому что, как и в случае с алюминием, образуется плотный оксидный слой, который защищает материал от дальнейшего окисления путем пассивации. Реакция на оксид индия (III) происходит только при высоких температурах.
Хотя индий подвергается воздействию минеральных кислот, таких как азотная или серная кислота, он не растворяется в горячей воде, щелочах и большинстве органических кислот. Даже соленая вода не атакует индий. Индий является наиболее растворимым металлом в ртути при комнатной температуре.
Изотоп
Существует 38 различных изотопов и еще 45 основных изомеров индия. 97В к 135В известном. В природе встречаются только два изотопа, 113In (64 нейтрона) с 4,29% и 115In (66 нейтронов) с долей 95,71% в естественном распределении изотопов. Общий изотоп 115In является слаборадиоактивным, это бета-излучатель с периодом полураспада 4,41 · 1014 Лет. Оба природных изотопа можно обнаружить с помощью ЯМР-спектроскопии. Самые стабильные искусственные изотопы 111В и 114mУ полужизни нескольких дней, 113mВсего за полтора часа. 111В и 113mОни используются в ядерной медицине.
Использовать
Металл

Индиевая проволока используется в индиевых уплотнениях.
Индий универсален, но его использование ограничено его редкостью и высокой ценой. Большая часть производимого индия не используется в качестве металла, а перерабатывается в ряд соединений. Только на производство оксида индия и олова в 2000 году было использовано 65% от общего объема производства индия. Другие соединения, такие как фосфид индия и арсенид индия, также получают из полученного индия. Более подробную информацию об использовании соединений индия можно найти в разделе Соединения.
Металлические детали могут быть защищены гальваническим покрытием из индия. Материалы из стали, свинца или кадмия, например, с таким покрытием, более устойчивы к коррозии от органических кислот или солевых растворов и, прежде всего, к истиранию. В прошлом защитные слои из индия часто использовались для подшипников скольжения в автомобилях или самолетах. Однако из-за резкого роста цен на индий это уже не экономично. Поверхности, покрытые индием, имеют высокую и равномерную степень отражения для всех цветов и поэтому могут использоваться в качестве зеркала.
Температура плавления индия относительно низкая и может быть определена очень точно. По этой причине это одна из фиксированных точек при настройке шкалы температур. Это свойство также используется для калибровки в динамической дифференциальной калориметрии (ДСК).
Из-за большого сечения захвата как медленных, так и быстрых нейтронов индий является подходящим материалом для управляющих стержней в ядерных реакторах. Индиевые фольги также могут использоваться в качестве детекторов нейтронов. Индий газонепроницаем и легко деформируется даже при низких температурах, поэтому его используют в так называемых индиевых уплотнениях в криостатах.
Индий также играет роль припоя для многих материалов благодаря некоторым особым свойствам. Он слегка деформируется только при остывании. Это особенно важно при пайке полупроводников для транзисторов. Тот факт, что индий также может паять неметаллические материалы, такие как стекло и керамика, также играет роль.
В «индиевых таблетках» германиевые пластинки были легированы с обеих сторон, чтобы получить первые транзисторы.
сплавы
Индий можно сплавить со многими металлами. Многие из этих сплавов, особенно с металлами висмутом, оловом, кадмием и свинцом, имеют низкую температуру плавления от 50 до 100 ° C. Это дает возможность применения, например, в спринклерных системах, термостатах и предохранителях. Поскольку свинец, который также можно использовать, ядовит, индий служит его безвредной заменой. Эти сплавы предназначены для плавления при слишком высоких температурах окружающей среды, вызванных огнем или сильным током. Затем таяние прерывает контур или запускает спринклерную систему. Сплавы индия с галлием часто имеют даже более низкие температуры плавления и содержатся в высокотемпературных термометрах. Галинстан - это специальный сплав галлий-индий-олово. Это жидкость при комнатной температуре, которая служит безвредной заменой ртути или натрий-калиевым сплавам.
Есть несколько других сплавов, содержащих индий, которые используются в различных областях. Индий используется с медью, марганцем и магнием в качестве компонента сплава в магнитных материалах. Иногда индий (максимум 5%) с серебром, оловом, медью, ртутью и цинком используется в качестве примеси в амальгамных пломбах. Слой хранения CD-RW, помимо прочего, содержит индий.
доказательство
Возможным химическим доказательством является осаждение ионов индия с помощью 8-гидроксихинолина из раствора уксусной кислоты. Обычно индий обнаруживают не химическими методами, а подходящими спектроскопическими методами. Индий легко обнаружить по характерным спектральным линиям 451,14 нм и 410,18 нм. Поскольку они находятся в синем спектральном диапазоне, получается типичный синий цвет пламени. Рентгенофлуоресцентный анализ и масс-спектрометрия доступны в качестве методов исследования для более точного количественного определения.
Токсичность и безопасность
Хотя металлы индия не обладают токсическим действием, в экспериментах на животных с крысами и кроликами было показано, что ионы индия оказывают эмбриональное и тератогенное действие. При разовой дозе 0,4 мг * кг-1 InCl3 У беременных крыс наблюдались такие пороки развития, как волчья пасть и олигодактилия. Эти явления чаще наблюдались при применении индия на 10-й день беременности. Напротив, у мышей не наблюдалось никаких пороков развития. Было обнаружено, что нитрат индия токсичен для водных организмов (водная токсичность).
Компактный металлический индий негорюч. С другой стороны, в мелкодисперсном состоянии в виде порошка или пыли, как и многие металлы, он легко воспламеняется и горюч. Горящий индий нельзя тушить водой из-за опасности взрыва выделяемого водорода, но его следует тушить металлическими огнетушителями (класс D).
Связи
Индий образует ряд соединений. В них металл обычно имеет степень окисления + III. Уровень + I встречается реже и нестабильнее. Степень окисления + II не существует, соединения, в которых формально присутствует двухвалентный индий, в действительности являются смешанными соединениями одновалентного и трехвалентного индия.
индий
Оксид индия (III) - стабильная соль желтого цвета. Чистый оксид индия (III) используется редко, в технологии большая его часть перерабатывается в оксид индия и олова. Это оксид индия (III), легированный небольшим количеством оксида олова (IV). Это превращает соединение в прозрачный и проводящий оксид (материал TCO). Такое сочетание свойств, которым обладают лишь некоторые другие материалы, означает, что они широко используются. Оксид индия и олова используется, в частности, в качестве проводника в жидкокристаллических экранах (LCD), органических светодиодах (OLED), сенсорных экранах и солнечных элементах. В других приложениях, таких как обогреваемые автомобильные окна и солнечные элементы, дорогой оксид индия и олова можно заменить более дешевым оксидом цинка, легированным алюминием.
Соединение полупроводника
Многие соединения индия представляют собой сложные полупроводники с характерной шириной запрещенной зоны. Это, в частности, относится к соединениям с элементами основных групп 15 и 16, такими как фосфор, мышьяк или сера. Те, у кого элементы 15-й основной группы, считаются полупроводниками соединения III-V, с халькогенами - полупроводниками соединения III-VI. Количество зависит от количества валентных электронов в двух соединяющих компонентах. Нитрид индия, фосфид индия, арсенид индия и антимонид индия имеют разные применения в различных диодах, таких как светоизлучающие диоды (LED), фотодиоды или лазерные диоды. Точное применение зависит от требуемой ширины запрещенной зоны. Сульфид индия (III) (In2S3) представляет собой полупроводник III-VI с шириной запрещенной зоны 2 эВ, который используется вместо солнечных элементов на основе сульфидина кадмия. Некоторые из этих соединений - в первую очередь фосфид индия и арсенид индия - играют роль в нанотехнологиях. Нанопроволоки из фосфида индия обладают сильно анизотропной фотолюминесценцией и, возможно, могут использоваться в высокочувствительных фотодетекторах или оптических переключателях.
Помимо простых составных полупроводников, существуют также полупроводниковые соединения, которые содержат более одного металла. Примером является арсенид индия-галлия (InxGa1-хAs) тройной полупроводник с уменьшенной запрещенной зоной по сравнению с арсенидом галлия. Диселенид меди-индия (CuInSe2) имеет высокую степень поглощения света и поэтому используется в тонкопленочных солнечных элементах (солнечных элементах CIGS).
Другие соединения индия
Индий образует ряд соединений с галогенами фтором, хлором, бромом и йодом. Они являются кислотами Льюиса и образуют комплексы с подходящими донорами. Важным галогенидом индия является хлорид индия (III). Он используется, среди прочего, в качестве катализатора восстановления органических соединений.
Существуют также органические соединения индия с общей формулой InR3 и InR. Как и многие металлоорганические соединения, они чувствительны к кислороду и воде. Органические соединения индия используются в качестве легирующих реагентов при производстве полупроводников.
| Общий | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Индий, В, 49 | |||||||||||||||||||||||||||||||||
| серия | металлы | |||||||||||||||||||||||||||||||||
| Группа, период, блок | 13, 5, стр. | |||||||||||||||||||||||||||||||||
| Внешний вид | серебристый блестящий серый | |||||||||||||||||||||||||||||||||
| номер CAS | 7440-74-6 | |||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 0,1 частей на миллион | |||||||||||||||||||||||||||||||||
| ядерной | ||||||||||||||||||||||||||||||||||
| атомная масса | 114,818 XNUMX человека | |||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 155 (156) вечера | |||||||||||||||||||||||||||||||||
| Ковалентный радиус | 144 м. | |||||||||||||||||||||||||||||||||
| Ван-дер-Ваальса радиус | 193 м. | |||||||||||||||||||||||||||||||||
| электронная конфигурация | [Kr] 4d105s25p1 | |||||||||||||||||||||||||||||||||
| 1. ионизация | 558,3 кДж / моль | |||||||||||||||||||||||||||||||||
| 2. ионизация | 1820,7 кДж / моль | |||||||||||||||||||||||||||||||||
| 3. ионизация | 2704 кДж / моль | |||||||||||||||||||||||||||||||||
| физически | ||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | |||||||||||||||||||||||||||||||||
| кристаллическая структура | четырехугольный | |||||||||||||||||||||||||||||||||
| плотность | 7,31 г / см3 | |||||||||||||||||||||||||||||||||
| твердость по Моосу | 1,2 | |||||||||||||||||||||||||||||||||
| магнетизм | диамагнитный ( = -5,1 10-5) = -5,1 10-5) |
|||||||||||||||||||||||||||||||||
| точка плавления | 429,7485[4] К (156,5985 ° С) | |||||||||||||||||||||||||||||||||
| Температура кипения | 2345 К (2072 ° С) | |||||||||||||||||||||||||||||||||
| Молярный объем | 15,76 · 10-6 m3/ моль | |||||||||||||||||||||||||||||||||
| Теплота парообразования | 231,8 кДж / моль | |||||||||||||||||||||||||||||||||
| теплота плавления | 3,26 кДж / моль | |||||||||||||||||||||||||||||||||
| упругость паров | 1 Па при 1196 К | |||||||||||||||||||||||||||||||||
| скорость звука | 1215 м / с на 293,15 K | |||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 233 Дж / (кг · К) | |||||||||||||||||||||||||||||||||
| Электропроводность | 12,5 · 106 А / (В · м) | |||||||||||||||||||||||||||||||||
| теплопроводность | 81,6 Вт / (м · К) | |||||||||||||||||||||||||||||||||
| Химический | ||||||||||||||||||||||||||||||||||
| состояния окисления | 3, 1 | |||||||||||||||||||||||||||||||||
| нормальный потенциал | −0,343 В (In3+ + 3e- → В) | |||||||||||||||||||||||||||||||||
| электроотрицательность | 1,78 (шкала Полинга) | |||||||||||||||||||||||||||||||||
| Изотоп | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| свойства ЯМР | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| безопасности | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
Индийская цена
Цены на индий -> Стратегические цены на металлы
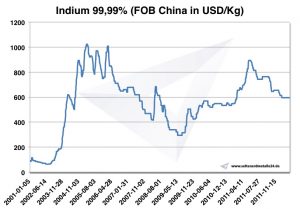
Диаграмма Индий 2001-2011



