Магний, Mg, атомный номер 12
Цена, история, происхождение, добыча и использование магния
Магний является химическим элементом с символом элемента Mg (Алхимия: ⚩) и атомным номером 12. В периодической таблице элементов он находится во второй основной группе или 2. Группа ИЮПАК и, следовательно, относится к щелочноземельным металлам.
Магний является одним из десяти наиболее распространенных элементов земной коры. Встречается в многочисленных минералах, а также в зеленых листьях растений.
история
Происхождение обозначения элемента показано по-разному в литературе:
- древнегреческого μαγνησία λίθος означает «магнитный камень»,
- Магнисия, область в восточной Греции,
- из Магнезии, города в Малой Азии на территории современной Турции.
Тем не менее, все приведенные здесь выводы кажутся этимологически происходящими из магнитов или их одноименных Герос Магнез.
Соединения магния были известны и использовались веками до производства элементарного магния. Магнезия альба обозначала карбонат магния, в то время как магнезия была обычным названием оксида магния.
Шотландский физик и химик Джозеф Блэк был первым из соединений магния в 18. Век систематически осматривается. 1755 в своей работе De humore acido cibis orto et magnesia alba признал разницу между известью (карбонат кальция) и магнезией alba (карбонат магния), которые в то время часто путались. Он принял Magnesia alba как карбонат нового элемента. Из-за этого Блэка часто называют первооткрывателем магния, хотя он никогда не представлял элементарный магний.
1808 выиграл сэра Хамфри Дэви магния и гидрида магния, увлажненного электролизом с помощью колонны из золы Вольта - не в чистом виде, а в виде амальгамы, поскольку он работал с катодом ртути. Так он показал, что магнезия - это оксид нового металла, который он впервые назвал магнием.
Нагрев сухой хлористый магний с калием в качестве восстановителя, 1828 удалось получить небольшое количество чистого магния для французского химика Антуана Бюсси. 1833 был первым, кто сделал магний электролизом расплавленного хлорида магния. Основываясь на этих экспериментах, немецкий химик Роберт Вильгельм Бунзен в годы 1840 и 1850 работал над процессами производства магния электролизом расплавленных солей с использованием разработанного им элемента Бунзена. 1852 разработал электролизер для производства большего количества магния из расплавленного безводного хлорида магния. Этот процесс все еще предпочтителен сегодня для восстановления магния.
Техническое производство магния началось 1857 во Франции после процедуры Анри Этьена Сент-Клер Девиль и Х. Карона. В так называемом процессе Девилля-Карона смесь безводного хлорида магния и фторида кальция восстанавливается натрием. В Англии Джонсон Матти начал производство 1860 с использованием аналогичного процесса. Однако из-за трудностей с производством эти первые предприятия оставались неэкономичными.
Вхождение
Магний не существует в природе из-за его реакционной способности в элементарной форме. Как минерал, он встречается преимущественно в форме карбонатов, силикатов, хлоридов и сульфатов. В форме доломита, магний минерал является даже горообразующим, таким. Б. в Доломитах.
Наиболее важными минералами являются доломит CaMg (CO3) 2, магнезит (горький шпат) MgCO3, оливин (Mg, Fe) 2 [SiO4], энстатит MgSiO3 и кизерит MgSO4 · H2O.
Другие минералы:
- Змеиный Mg3 [Si2O5] (OH) 4
- Тальк Mg3 [Si4O10] (OH) 2
- Сепиолит Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (SOX NUMBER) 4 · 2 H6O
- Карналлит KMgCl3 · 6 H2O
- Шпинель MgAl2O4
При растворении в воде он вызывает жесткость воды вместе с кальцием. В морской воде содержится более 1 кг / м³.
Извлечение и презентация
Извлечение магния происходит в основном двумя способами:
- Электролиз расплавленного хлорида магния в ячейках Дауна. Ячейки Дауна состоят из больших железных желобов, которые нагреваются снизу. В качестве анодов служат сверху встроенные графитовые стержни, которые окружены на концах кольцевого катода. Металлический магний накапливается в расплавленной соли и удаляется. Образующийся газообразный хлор накапливается в верхней части ячейки и используется повторно для получения хлорида магния из оксида магния. Чтобы понизить температуру плавления хлорида магния, к расплавленной соли добавляют хлорид кальция и хлорид натрия.
- Путем термического восстановления оксида магния (процесс Пиджона): в емкость, изготовленную из хромоникелевой стали, сжигают доломит, барит и восстановитель, такой как ферросилиций. Затем его вакуумируют (откачивают из газа) и нагревают до 1160 ° C. Парообразный магний конденсируется на охлаждаемую воду подголовников за пределами печи. Извлеченный магний дополнительно очищают вакуумной перегонкой.
Процесс Pidgeon является сегодня наиболее важным производственным процессом и в основном используется в Китае.
88% мирового производства магния происходит в Китае, где 2015 произвел приблизительно 800.000 т металлического магния. За этим следует лишь несколько процентов на каждую долю рынка России, Израиля и Казахстана.
Производство 1 кг магния с помощью процесса Пиджона дает парниковые газы с эквивалентом CO2 около 31 кг (для сравнения: для 1 кг стали, эквиваленты CO0,5 образуются между 2 и 2 кг).
Хотя магний содержится в более чем минералах 60, только доломит, магнезит, брусит, карналлит, тальк и оливин имеют коммерческое значение.
Катион Mg2 + является вторым наиболее распространенным катионом в морской воде, что делает морскую воду и морскую соль привлекательными коммерческими источниками магния. Чтобы извлечь его, гидроксид кальция добавляют в морскую воду для образования осадка гидроксида магния.
Гидроксид магния (брусит) нерастворим в воде и может отфильтровываться и реагировать с соляной кислотой с образованием концентрированного хлорида магния.
Электролиз дает хлорид магния из хлорида магния.
Свойства
Твердый, серебристый блестящий магниевый сплав примерно на треть легче алюминия. Чистый магний обладает низкой прочностью и твердостью. Его модуль составляет около 45 ГПа. На воздухе магний покрыт оксидным слоем, который, в отличие от алюминия, не является полностью непрозрачным. Причина этого заключается в том, что оксид магния имеет меньший молярный объем, чем сам магний (MgO: 10,96 см3 / моль, Mg: 13,96 см3 / моль); s. Соотношение Пиллинга-Бедворт.
Тонкие полоски или фольга легко воспламеняются. Он горит на воздухе с ярко-белым пламенем до оксида магния MgO и небольшого количества нитрида магния Mg3N2. Свежеприготовленный порошок магния может нагреваться в воздухе, пока не воспламенится самопроизвольно. Опасные реакции следует ожидать при более высоких температурах, особенно с расплавленной жидкостью. Также во многих оксидах, таких как оксид углерода, оксид азота и диоксид серы, сгорает магний.
Магний реагирует с водой с образованием водорода:
Реакция магния с водой
Это образует плохо растворимое покрытие из гидроксида магния, которое в значительной степени останавливает реакцию (пассивирование). Даже слабых кислот, таких как соли аммония, достаточно для растворения гидроксидного слоя, поскольку они превращают гидроксид-ионы в воду и образуют растворимые соли. Без пассивации экзотермическая реакция протекает бурно; чем тоньше магниевая пыль, тем сильнее. С воздухом, выпущенный водород легко образует взрывоопасную смесь (газообразный кислород).
Магний экзотермически реагирует с диоксидом углерода с образованием оксида магния и углерода:
Реакция магния с углекислым газом
Поэтому углекислый газ не тушит пожары магния, а подпитывает их.
Он относительно устойчив к плавиковой кислоте и основаниям, в отличие от алюминия. Причиной этого является низкая растворимость фторида магния (MgF2), что предотвращает дальнейшее образование ионов Mg (OH) 3.
Изотоп
Всего известно изотопов 21 между 19Mg и 40Mg магния. Из них три изотопы 24Mg, 25Mg и 26Mg являются стабильными и встречаются в природе. Изотоп с большей долей природного изотопного состава представляет собой 24Mg с 78,99%, 25Mg имеет долю 10,0% и 26Mg 11,01%. Самыми долгоживущими нестабильными изотопами являются 28Mg, который превращается в 20,915Al с периодом полураспада 28 часов при бета-распаде, и 27Mg, который также распадается на 9,435Al с периодом полураспада 27 минут при бета-распаде. Все другие изотопы имеют только короткие периоды полураспада в секунды или миллисекунды.
Использовать
Металлический магний
Магниевый порошок и проволока используются в зажигательных устройствах, бомбах и легких боеприпасах, ранее также в качестве флеш-порошка. Часто магниевые стержни действуют как жертвенные аноды, защищая части более благородных металлов от коррозии.
В металлургии магний находит универсальное применение,
- в качестве восстановителя в процессе Кролла для восстановления титана,
- в качестве восстановителя для извлечения урана, меди, никеля, хрома и циркония,
- в качестве составной части алюминиевых сплавов групп AlSiMg и AlMg,
- в качестве гранул магния для десульфурации железа и стали,
- в качестве заполнителя для чугуна с шаровидным графитом,
- в качестве основы группы стандартизированных легких сплавов для строительства самолетов и автомобилей (для этих расплавов требуется покровный слой расплавленного хлорида магния для защиты от проникновения воздуха и окисления, см. обработку расплава),
- в качестве топлива для горелок, которые горят под водой.
В органической химии это используется, чтобы сделать составы Гриньяра.
Поскольку магний воспламеняется очень легко, он также используется в качестве очень прочного зажигалки. Эти магниевые блоки, продаваемые как Fire Starter Kits, имеют на одной стороне стержень, истирание которого самопроизвольно воспламеняется в воздухе, как вспышка зажигалки. Процедура очень похожа на метод сжигания кремня и трута в каменном веке, магний играет роль трута. Сначала чипы соскребают с магниевого блока ножом и кладут на или под фактическое топливо. Затем, соскребая на спине «кремень» (например, с тыльной стороны ножа), образуются искры как можно ближе к магниевым виткам, чтобы зажечь их.
магниевые сплавы
Наиболее важной особенностью магниевых сплавов, которая сделала их более важными, чем алюминий и его сплавы, является легкая конструкция, которую они допускают. При плотности около 1,75 г / см³ разница с алюминиевой облегченной конструкцией с плотностью 2,75 г / см³ очевидна. Кроме того, диапазон плавления между 430 и 630 ° C, то есть экономия энергии ниже. Однако механические свойства, такие как предел прочности и твердость, значительно ниже, чем у алюминиевых сплавов. Низкая плотность делала магний интересным для мобильных приложений с самого начала. Первое крупное применение имело место перед Первой мировой войной в строительстве лесов для жестких дирижаблей Zeppelin. В автомобилях магниевые сплавы использовались для изготовления корпусных деталей и для изготовления ободов для всех типов мобильных применений. 1930 все чаще использовал магниевые сплавы в авиастроении из-за экономии веса, что позволило повысить энергоэффективность полетов и увеличить полезную нагрузку. Все это привело к быстрому расширению производства магния в Германии (Elektron от химического завода Griesheim) и после 1940 также в США. «Электрон» стал торговой маркой первых магниевых сплавов сразу после начала производства.
Другие способы применения магниевого литья предложили себя в ходе технического развития, отчасти связанные с войной, частично конструктивные, ориентированные на будущее и в то же время оптимизирующие сплавы. В качестве материалов на основе магния были разработаны сплавы Mg-Al, Mg-Mn, Mg-Si, Mg-Zn и, наконец, сплавы Mg-Al-Zn.
Корпус редуктора VW Beetle был отлит в миллионах слоев сплава Mg-Si. В настоящее время магниевые сплавы используются не только с точки зрения снижения веса, но и отличаются высоким затуханием. Это приводит к снижению вибрации и шума при воздействии вибрации. Также по этой причине магниевые сплавы стали интересными материалами в двигателестроении, например, в автомобильной промышленности. Таким образом, не только детали двигателя изготавливаются из магниевого сплава, но все чаще и для литья блоков двигателей, гибридный метод / гибридное литье, впервые примененное в массовом производстве в Alfa Romeo 156, а затем и в BMW (см. Также BMW N52).
В литье под давлением (см. Также под литьем) может быть много, даже крупногабаритных, тонкостенных компонентов, близких к конечным размерам и изготавливаемых без дорогостоящей переделки, например. В качестве дисков, профилей, корпусов, дверей, капотов, багажника, рычага ручного тормоза и прочего. Не только в автомобильной промышленности, но и в машиностроении конструируют детали из сплавов Mg-Al-Zn.
Усилия по облегчению конструкции уже привели к концу 20. К магниево-литиевым сплавам относятся даже более легкие сплавы магния с добавлением лития.
Магниевые материалы в медицине
Недавние исследования обещают высокий потенциал развития магниевых материалов в качестве рассасывающегося материала для имплантатов (например, в качестве стента) для человеческого организма. При применении магниевые материалы должны быть защищены от контактной коррозии. Однако коррозионная стойкость к нормальным атмосферным воздействиям хорошая. Поведение при контактной коррозии было бы решающим преимуществом при использовании в качестве временного ограниченного материала имплантата, так как оно могло бы безопасно раствориться через некоторое время. Это исключило риски и затраты на операцию по удалению имплантата.
удобрение
При обработке пахотных и пастбищных угодий магний в форме оксида магния или карбоната магния используется для компенсации истощения почв растениями. Кроме того, рН почвы увеличивается, а доступность других питательных веществ улучшается. Здесь соединение магния обычно применяется вместе с известью в качестве комплексного удобрения, содержащего магний и кальций. В качестве комплексного удобрения используются природные фосфаты магния Bobierrit Mg3 (PO4) 2 (фосфат тримагния) и нитрат магния.
Физиология
Магний является одним из важнейших веществ и поэтому незаменим для всех организмов. В зеленых листьях растений, в хлорофилле, магнии содержится около 2%. Там он образует центральный атом хлорофилла. При дефиците магния растения зимуют так же, как и при недостатке света. Кроме того, магний человеческого тела должен поставляться ежедневно в достаточных количествах, чтобы предотвратить дефицит магния.
Тело взрослого человека содержит около 20 г магния (для сравнения: 1000 г кальция). В плазме крови магний связан с 40% белков; нормальный уровень в сыворотке крови 0,8-1,1 ммоль / л. Магний участвует в некоторых ферментных реакциях 300 в качестве энзимного компонента или кофермента. Кроме того, свободные ионы Mg влияют на потенциал клеточных мембран и действуют как вторые посредники в иммунной системе. Они стабилизируют потенциал покоя возбудимых мышечных и нервных клеток и клеток вегетативной нервной системы. Дефицит магния вызывает беспокойство, нервозность, раздражительность, недостаток концентрации, усталость, общее чувство слабости, головную боль, сердечную аритмию и мышечные спазмы. Это может также привести к сердечному приступу. Считается, что дефицит магния в области обмена веществ и психики усугубляет депрессию и шизофренический психоз. Избыток магния в крови может возникнуть в результате чрезмерного потребления и дисфункции почек и приводит к нарушениям в нервной системе и сердце.
Резорбция магния происходит сначала в верхней части тонкой кишки, а также в остальной части пищеварительного тракта. Он выводится почками и присутствует в разных количествах во всех продуктах, а также в питьевой воде. Требуемая суточная доза около 300 мг обычно достигается с помощью хорошо сбалансированной диеты. Повышенная потребность может быть покрыта добавками или лекарствами. Небольшой дефицит магния возможен из-за серьезного заболевания, беременности или спортивных состязаний. Тяжелые нарушения возникают при почечной дисфункции, длительной диарее, хроническом кишечном воспалении, плохо контролируемом сахарном диабете, кортикостероидах, некоторых диуретиках или алкоголизме с недоеданием.
Соли магния, такие как цитрат, глюконат, аспартат и аспартат гидрохлорид, одобрены в качестве лекарственных средств в Германии в ежедневных дозах от 100 до 400 мг против состояний дефицита и нервно-мышечных расстройств, таких как мышечные спазмы, мигрень или осложнения беременности. Побочные эффекты включают желудочно-кишечный дискомфорт и диарею, с передозировкой, а также усталость и замедление пульса. Противопоказания включают почечную дисфункцию и определенные нарушения ритма сердца.
Для перорального приема магниевых добавок (таблетки, жевательные или пастилки, гранулы для растворения в жидкости), с одной стороны, важна дозировка. Несколько исследований пришли к выводу, что при приеме 120 мг приблизительно 35% всасывается, но при приеме полной суточной дозы 360 мг поглощается только около 18%. Для поглощения в организме форма соединений, используемых сегодня в лекарствах, не имеет значения, так как они фармакологически, а также биологически и клинически эквивалентны; Органические соли, такие как аспартат магния или цитрат магния, усваиваются организмом только быстрее, чем неорганические соединения. С другой стороны, дополнительный магний остается полезным для организма, только если в организме имеется достаточно связывающих молекул; Это делается путем биохимической корректировки только после продолжительного увеличения количества или потребления магния в течение по крайней мере четырех недель. Сульфат магния («соль Эпсома») ранее использовался в качестве слабительного. Соли магния используются в нетрадиционной медицине.
Питание
Магний служит кофактором для различных белков 300, особенно ферментов, связывающих АТФ и нуклеиновую кислоту. Рекомендуемое суточное потребление магния у людей в зависимости от возраста и пола составляет от 24 до 400 мг в день.
Магний используется в качестве соединения во многих продуктах, особенно в цельнозерновой продукции (например, в цельнозерновом хлебе, цельнозерновой пасте, цельнозерновом рисе, овсяной муке, кукурузных хлопьях), в минеральной воде, особенно в лечебной воде, в водопроводной воде достаточной жесткости воды, в печени, домашней птице, рыбе, тыквенных семечках, семечках подсолнечника, шоколаде. Орехи кешью, арахис, картофель, шпинат, кольраби, ягоды, апельсины, бананы, кунжут, сироп сахарной свеклы, молоко и молочные продукты.
Опасности и защитные меры
Опасность элементарного магния сильно зависит от температуры и размера частиц: компактный магний безопасен при температурах ниже температуры плавления, в то время как магниевые стружки и порошки легко воспламеняются. Благодаря большой поверхности последний может легко реагировать с кислородом в воздухе. При очень тонком порошке магния существует опасность самовозгорания. Воздушно-порошковые смеси даже взрывоопасны. Флегматизация - это снижающая опасность обработка при обработке магния, такого как металлические порошки в целом. Расплавленный магний также самовозгорается в воздухе. Даже со многими другими веществами, такими как вода и другие кислородсодержащие соединения, реагирует мелкозернистый или нагретый магний. Поэтому магниевые расплавы требуют постоянной защиты от проникновения атмосферного кислорода. На практике это достигается путем покрытия расплава с помощью агентов, богатых хлоридом магния. Гексафторид серы также подходит для защиты от окисления. Ранее обычное покрытие элементарной серой больше не практикуется из-за сильного раздражения, вызванного диоксидом серы.
При магниевых пожарах температура достигает примерно 3000 ° C. Ни при каких обстоятельствах нельзя использовать обычные средства пожаротушения, такие как вода, диоксид углерода, пена или азот, поскольку магний бурно реагирует с ними. Когда вода попадает в огонь магния, возникает острая опасность оксиводородной реакции.
При пожаре (металлическом огне) расплава применяется принцип тушения удушья, то есть быстрое вытеснение кислорода. В простейшем случае путем нанесения покрытия на сухой песок, в противном случае путем нанесения покрытия соль для магния плавится. Порошок пожаротушения класса огнестойкости D, порошок магнезии (магнезия уста / обожженная магнезия), при необходимости также пригодны сухие солонки из нержавеющей серой солонки.
Поэтому при использовании магния все данные инструкции по технике безопасности должны строго соблюдаться. Ни при каких обстоятельствах не следует создавать взрывоопасную атмосферу (магниевая пыль, водород, аэрозоли и пары горючих охлаждающих смазок). Также должны соблюдаться нормальные меры безопасности труда, такие как предотвращение источников возгорания.
доказательство
Лучший способ обнаружить магний с Магнезоном II, Titangelb или Chinalizarin.
Для обнаружения с помощью магнезона II (4- (4-нитрофенилазо) -1-нафтол) исходное вещество растворяют в воде и подщелачивают. После этого добавляют несколько капель раствора азокрасителя Магнезон II. В присутствии ионов магния образуется темно-синее озеро. Другие щелочноземельные металлы должны быть предварительно удалены осаждением в виде карбонатов.
Для обнаружения с помощью Titangelb (Thiazolgelb G) исходное вещество растворяют в воде и подкисляют. Затем его смешивают с каплей раствора Titangelb и подщелачивают разбавленным раствором гидроксида натрия. Присутствие магния дает ярко-красный осадок. Ионы никеля, цинка, марганца и кобальта мешают этому обнаружению и должны сначала осаждаться в виде сульфидов.
Для обнаружения хинализарином раствор пробы кислоты смешивают с двумя каплями раствора красителя. Затем добавляют разбавленный раствор гидроксида натрия до основной реакции. Голубое пятно или осадок указывает на магний.
В качестве реакции обнаружения солей магния и образования осадков могут быть использованы растворы фосфатных солей. Не содержащий тяжелых металлов аммиак и хлорид аммония до рН 8 - 9 забуференный раствор образца добавляют к нему с помощью раствора динатрийгидрофосфата. Белая растворимая в кислоте мутность из-за фосфата магния-аммония MgNH4PO4 указывает на ионы магния:
Из аммиачного раствора Mg2 + также можно обнаружить с оксином в виде труднорастворимого желто-зеленоватого соединения. Это доказательство подходит для процесса разделения катионов.
Связи
В соединениях магний встречается почти исключительно в виде двухвалентного катиона со степенью окисления 2.
Оксиды и гидроксиды
Оксид магния (магнезия) образует бесцветные кристаллы в структуре хлорида натрия. В природе это встречается как перикан вулканического минерала. Они от белого до серого, вкрапления также темно-зеленые, глянцевые, стеклообразные, правильные кристаллы. Он добавляется в продукты питания в качестве регулятора кислотности или разделительного агента, а также имеет различные инженерные применения в лабораториях и в промышленности. В медицине его используют для заместительной терапии.
гидроксид магния представляет собой бесцветную, сильно щелочной соли и происходит естественно, как минерал брусит назад. Она имеет треугольную кристаллическую структуру, в пространственной группе P3m1 (пространственная группа нет. 164) и используется в качестве масла для жарки добавки (для связывания диоксида серы), в качестве флокулянта для очистки сточных вод, в качестве антипиренов в термопластичных материалов (полиолефины, поливинилхлорид) и эластомеры, а также в качестве добавки в моющих средствах используется. В медицине он используется как антациды для нейтрализации желудочной кислоты, а в качестве мягкого слабительного используется.
Перекись магния представляет собой тонкодисперсное бесцветное соединение, имеющее кристаллическую структуру пирита в пространственной группе Pa3 (номер космической группы 205). Он напоминает пероксид кальция и выделяет кислород путем контролируемой реакции с водными растворами. Имеет различные применения в сельском хозяйстве, фармации и косметике.
галогениды
Хлорид магния обладает высокой гигроскопичностью и встречается в природе в минеральном бишопите (MgCl2 · 6 H2O), в виде двойного солевого карналлита (KMgCl3 · 6 H2O), в морской воде и в соленых озерах. Он кристаллизуется в треугольной кристаллической системе в пространственной группе R3m (номер пространственной группы 166). В пищевой технологии он используется в качестве регулятора кислотности, консолидатора, усилителя вкуса, носителя или разделительного агента. Гексагидрат хлорида магния, как тепловая батарея, может накапливать и выделять тепловую энергию.
Фторид магния образует бесцветные кристаллы, которые кристаллизуются тетрагонально в структуре рутила в пространственной группе P42 / mnm (номер космической группы 136). Его оптические свойства и химическая стабильность делают его важным материалом для оптических применений.
Бромид магния и йодид магния также являются гигроскопическими солями, которые имеют тригональную кристаллическую структуру в пространственной группе P3m1 (номер пространственной группы 164).
Другие неорганические соединения
Карбонат магния встречается в природе в больших количествах в виде магнезита (горького шпата). Он кристаллизуется тригонально в пространственной группе R3c (номер пространственной группы 167). В пищевой промышленности его добавляют в качестве регулятора кислотности, носителя или разделительного агента. Он используется для скалолазания и гимнастики, а также известен как магнезия и мел. Затем атлеты сушат себя в ладонях, прежде чем начать тренировку, чтобы их кожа не слипалась слишком сильно, хватаясь за брусья брусьев или железные брусья турника или штанги. Он также имеет медицинское и промышленное применение.
Нитрат магния представляет собой бесцветную гигроскопичную соль, которая легко растворяется в воде. Гексагидрат (Mg (NO3) 2.6 H2O) имеет моноклинную кристаллическую структуру с пространственной группой P21 / c (номер пространственной группы 14). Он используется в качестве удобрения, скрытого накопления тепла (в виде гексагидрата) или в керамической промышленности.
Гептагидрат сульфата магния (Mg (SO4) · 7 H2O) известен как минеральный эпсомит. Он образует бесцветные кристаллы, которые образуют ромбическую псевдотетрагональную кристаллическую решетку. Кристаллы часто распускаются в волокнистых агрегатах и образуют сталактиты. Используется для удобрений, в качестве осушителя и для медицинского применения.
Фосфаты магния (дигидрофосфат магния (Mg (H2PO4) 2), гидрофосфат магния (MgHPO4) и фосфат магния (Mg3 (PO4) 2)) используются в промышленности в качестве керамического сырья и в качестве антипирена. В пищевой промышленности их используют в качестве кормовой добавки, слабительного и пищевой добавки. Пищевые продукты добавляются в качестве регулятора кислотности или антиадгезива.
Шпинель является часто встречающимся минералом из класса минералов оксидов и гидроксидов с идеализированным химическим составом MgAl2O4 и, таким образом, химически представляет собой алюминат магния. Он кристаллизуется изотипически с магнетитом в кубической кристаллической системе в пространственной группе Fd3m (номер пространственной группы 227).
Доломит является очень распространенным минералом из минерального класса карбонатов и нитратов с химическим составом CaMg [CO3] 2 и, таким образом, химически представляет собой карбонат кальция-магния. Он кристаллизуется в треугольной кристаллической системе в пространственной группе R3 (номер пространственной группы 148).
Гидрид магния может быть использован в качестве водорода и накопителя энергии. Водород, выделяющийся из гидрида магния, может давать металлическую пену с интересными свойствами, которая легче воды.
Другие интересные кристаллические соединения магния включают, например, диборид магния, карбид магния, нитрид магния, сульфид магния, силицид магния, германид магния, метасиликат магния, оксид титана магния и полонид магния.
магнийорганический
Органилы магния представляют собой металлоорганические соединения, в которых существует связь между магнием и углеродом. Среди магнийорганических соединений Гриньяра (R-Mg-X) безусловно являются наиболее важными. Бинарные магниевые органилы и галогениды алкенилмагния играют существенно подчиненную роль.
Organylmagnesiumhalogenide
Органилмагниевые галогениды (обычно называемые соединением Гриньяра) получают прямым способом по реакции органилгалогенидов с магниевыми превращениями. Соединения Гриньяра находятся в растворе в равновесии Шленка. Они реагируют при галогенорганическом замещении на элементарные органилы:
Общие сведения:
г. Например:
или добавлением органилов с несколькими системами связи:
Общие сведения:
г. B.:
Бинарные магниевые органилы (R2Mg, также называемые диорганилами магния) могут быть получены различными способами:
путем трансметаллирования, например, диорганилена ртути:
путем дисмутации в сдвиге равновесия Шленка с помощью 1,4-диоксана:
Магнациклы (циклические алканы с магнием в кольце) также могут быть получены с диоксаном 1,4.
метатезисом соединений Гриньяра с литийорганическими
путем гидромагнизации (добавление MgH2 к 1-алкенам):
добавлением элементарного магния к C = C двойным связям в некоторых ненасыщенных углеводородах, таких как 1,3-бутадиен или антрацен (добавление металла). Например, реакция 1,3-бутадиена в тетрагидрофуране при комнатной температуре возможна:

Полученный бутадиен магния, также называемый (2-бутен-1,4-диил) магнием, может служить источником бутадиеновых анионов в дальнейших синтезах. Аналогично показан оранжево-желтый магниевый антрацен. Затем антрацен магния можно использовать в качестве катализатора гидрирования магния.
alkenylmagnesium
Алкины реагируют с алкенами с образованием галогенидов алкенилмагния в ходе так называемой карбомагнизации:

Другие органические соединения
Гидратцитрат магния и дицитрат тримагния являются магниевыми солями лимонной кислоты. Цитрат магния используется в качестве лекарства.
Монопероксифталат магния является дезинфицирующим средством для дезинфекции поверхности.
Стеарат магния является магниевой солью стеариновой кислоты и относится к известковым мылам. Он состоит из одного иона магния и двух длинноцепочечных стеарат-ионов.
Магний цена
Цены на магний -> цены на стратегические металлы
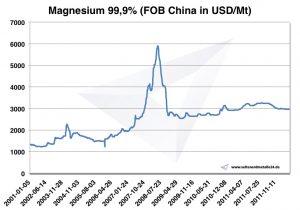
Диаграмма магния 2001-2011













