Молибден, Мо, атомный номер 42
Цена, история, происхождение, добыча и использование молибдена
Молибден (греч. Μόλυβδος молибдошеелита «Свинец») представляет собой химический элемент с символом элемента Мо и атомным номером 42. Это один из переходных металлов, в периодической таблице он находится в 5-м периоде и 6-й подгруппе (группа 6) или группе хрома.
Молибден, который обычно находят в месторождениях как молибденовый блеск (дисульфид молибдена), долгое время путали со свинцовым блеском или графитом. В 1778 году Карлу Вильгельму Шееле удалось превратить блеск молибдена в белый оксид молибдена (VI) (также триоксид молибдена) MoO путем обработки азотной кислотой.3 (Вода свинцовая земля). В 1782 году Питер Якоб Хьельм восстановил оксид молибдена до элементарного угля. Из-за его сложной обрабатываемости (чистый молибден можно пластически деформировать, но загрязнение десятитысячной долей кислорода или азота делает молибден чрезвычайно хрупким) долгое время молибден игнорировался. В конце 19 века сотрудники французской компании Schneider & Co. заметили полезные свойства молибденовых сплавов при производстве армированных труб. В двух мировых войнах спрос на металл был велик, после Второй мировой войны цены резко упали. Единственный западноевропейский рудник эксплуатировался в Кнабене, Норвегия, до 1973 года.
Вхождение
Молибден в основном поступает в виде молибденита (молибденовый блеск, MoS2) с концентрацией около 0,3%. Также присутствует вульфенит (желтая свинцовая руда, PbMoO4) и Powellit Ca (Mo, W) O4. Побочный продукт - молибденит, получаемый при добыче меди, в основном используется для плавки. Мос2-Концентрат, покидающий шахту в направлении «жаровни», содержит около 50–60% молибдена. Крупные месторождения находятся в США, Чили, Китае, Канаде и Перу. Мировое производство в 2007 году составило 211.000 2006 тонн (в 179.000 году - 2007 62.000 тонн). В 60.000 году США, как крупнейший производитель, произвели 45.000 XNUMX тонн, Китай XNUMX XNUMX тонн и Чили XNUMX XNUMX тонн.
Молибден в достойной, то есть в элементарной форме, до сих пор был обнаружен только в четырех образцах (статус: 2011): на Земле в образце горной породы из вулкана Корякская Сопка на российском полуострове Камчатка и в трех образцах горных пород с Луны с Аполлониевого нагорья (Луна 20 ), Mare Crisium (Luna 24) и Mare Fecunditatis (Luna 16). Однако, поскольку открытия были опубликованы без проверки IMA / CNMNC, статус молибдена как минерала еще не подтвержден, даже если минеральная система отсутствует. 1.AC.05 (на основе 9-го издания минеральной систематики Струнца).
Извлечение и презентация
Большая часть молибдена получается как побочный продукт при производстве меди и только около 30% непосредственно из молибденовых руд. Все руды в основном перерабатываются в гептамолибдат аммония. Его получают путем прокаливания при температуре около 400 ° C в триоксиде молибдена MoO.3 осужден. Последний восстанавливается до чистого порошка молибдена в две стадии с использованием водорода. На первом этапе образуется метастабильный диоксид молибдена коричнево-фиолетового цвета MoO при 500–600 ° C.2, вторая стадия приводит к получению чистого металлического порошка примерно при 1100 ° C. Сжатие в компактный металл происходит с помощью процесса HIP, переплавки в дуговой печи в атмосфере аргона в качестве защитного газа или в электронно-лучевой печи. Монокристаллы производятся методом зонной плавки. Извлечение молибдена из лома составляет почти 100%, поскольку отсутствуют потери на окисление.



Свойства
Молибден - переходный металл 5-го периода. Высокопрочный, прочный и твердый металл имеет серебристо-белый блеск. У него самая высокая температура плавления из всех элементов 5-го периода. Как и тяжелый гомолог вольфрама, он не подвергается воздействию восстанавливающих кислот (включая плавиковую кислоту). Вот почему молибден в больших количествах используется для производства кислотостойких нержавеющих сталей и никелевых материалов. Окисляющие кислоты, такие как горячая концентрированная серная кислота, азотная кислота или царская водка, обеспечивают высокую скорость удаления. Молибден так же нестабилен в окисляющих щелочных расплавах.
Использовать
В небольших количествах он используется для упрочнения и предотвращения охрупчивания стали при отпуске. Более двух третей производимого молибдена используется для производства металлических сплавов, таких как ферромолибден. Дефицит вольфрама во время Первой мировой войны привел к увеличению использования молибдена для производства высокопрочных материалов. По сей день молибден является легирующим элементом, который используется для повышения прочности, коррозионной и жаростойкости. Высококачественные материалы, содержащие молибден, такие как хастеллой.®Инколой® или никрофер® Многие технические процессы сделали это возможным или экономически целесообразным.
Из-за своей высокой термостойкости молибден используется в производстве деталей для экстремальных условий, таких как Б. используется в авиакосмической промышленности или металлургии. В нефтепереработке он используется в качестве катализатора для удаления серы.
Благодаря своей слоистой структуре дисульфид молибдена является идеальным смазочным материалом даже при повышенных температурах. Его можно использовать в твердом виде, например графит, а также в виде суспензии в обычных смазочных маслах.
Молибден также можно найти в электронных компонентах. В TFT (тонкопленочных транзисторах) он служит проводящим металлическим слоем, а также в тонкопленочных солнечных элементах он используется в качестве металлического обратного проводника.
Молибденовые фольги служат в качестве газонепроницаемых вводов тока в кварцевом стекле и т. Д. а. на галогенные лампы накаливания и газоразрядные лампы высокого давления.
Молибдаты используются для пропитки тканей, чтобы сделать их огнестойкими.
Молибден также используется в рентгеновской диагностике в качестве материала мишени в аноде. Рентгеновские трубки с молибденовым анодом используются из-за меньшей энергии характеристического рентгеновского излучения (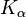 на 17,4 кэВ и
на 17,4 кэВ и 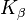 при 19,6 кэВ по сравнению с 58 / 59,3 кэВ или 67,0 / 67,2 / 69,1 кэВ вольфрама) молибдена v. а. используется при обследовании женской груди (маммография).
при 19,6 кэВ по сравнению с 58 / 59,3 кэВ или 67,0 / 67,2 / 69,1 кэВ вольфрама) молибдена v. а. используется при обследовании женской груди (маммография).
В ядерной медицине расщепленный молибден используется в генераторах технеция-99m. Относительно длительный 99Mo (HWZ 66 h) распадается внутри ГСЧ на 99mTc (технеций, период полураспада 6 ч). Таким образом, этот важный изотоп технеция можно получить непосредственно на месте для исследовательских целей.
Физиология

Бактериальный молибденовый кофактор бис (молибдоптерин-гуанин динуклеотид) молибден
Как микроэлемент, молибден необходим почти для всех живых организмов, поскольку он является важным компонентом активного центра ряда ферментов, таких как нитрогеназа, нитратредуктаза и сульфитоксидаза. Живые существа используют ферменты, содержащие молибден и тому подобное. а. для разложения пурина и образования мочевой кислоты. Биодоступность, т.е. ЧАС. форма молибдена, попадающая в организм организмов, - это ион молибдата MoO42-. Он вводится в соответствующие ферменты в несколько этапов в виде кофакторов молибдена. Здесь атом Мо может переключаться между координационными числами + IV, + V и + VI и, таким образом, катализировать одноэлектронные окислительно-восстановительные реакции.
Молибден необходим растениям. Недостаток молибдена может сделать почву стерильной, что объясняет, почему удобрение гептамолибдатом аммония увеличивает урожайность на таких почвах. Концентрация молибдена в растениях и животных составляет несколько частей на миллион. Молибден - очень важный микроэлемент, особенно для бобовых. Бактерии, живущие в симбиозе с бобовыми (клубеньковые бактерии), способны связывать атмосферный азот с помощью фермента, содержащего молибден (нитрогеназу). Молибден нужен для двух процессов: фиксации молекулярного азота и восстановления нитратов.
Молибден также необходим для питания человека. Оценка DGE для подростков и взрослых предполагает 50–100 мкг молибдена в качестве подходящей суточной дозы. Дефицита молибдена не возникает. Если достигается высокое потребление (10-15 мг / день) - например, из-за богатой молибденом почвы, возникают симптомы, похожие на подагру, боли в суставах и увеличение печени.
Однако дефицит кофактора молибдена возникает только как наследственное заболевание; мутировал один из ферментов, катализирующих биосинтез кофакторов молибдена.
безопасности
Молибденовая пыль и соединения, такие как оксид молибдена (VI) и водорастворимые молибдаты, проявляют небольшую токсичность при вдыхании или пероральном приеме.
Испытания показывают, что молибден, в отличие от многих других тяжелых металлов, обладает относительно небольшой токсичностью. Острые отравления маловероятны из-за необходимого количества. В области добычи и производства молибдена может наблюдаться более высокая экспозиция молибдена. Однако до сих пор ни о каких случаях заболевания не стало известно.
доказательство
Качественное доказательство шестивалентного молибдена возможно через образование гетерополикислот с фосфатом. Если фосфорную кислоту добавить в раствор, содержащий молибдат, содержащий серную кислоту, образуется кристаллический гель молибдена. Если добавить мягкий восстанавливающий агент аскорбиновую кислоту, он станет ярко-синего цвета (образование молибденового синего). При более низких концентрациях молибдата не происходит выпадения осадка, только изменение цвета раствора.
![\ Mathrm {H_2PO_4 ^ - + 12 \ MoO_4 ^ {2-} + 6 \ H_3O ^ + 3 \ NH_4 ^ + \ Longrightarrow (NH_4) _3 [Р (Mo_3O_ {12}) _ 4] (желтый) + 10 \ H_2O }](https://upload.wikimedia.org/wikipedia/de/math/5/4/e/54e88a032d7745b68a3b0d7bc5907c31.png)
Эти реакции также используются для фотометрического определения молибдата или фосфата в следовых количествах. Как вариант, молибден можно определить с помощью атомной спектрометрии. В полярографии шестивалентный молибден в серной кислоте с концентрацией 0,5 моль / л дает два уровня при -0,29 и -0,84 В (по сравнению с SCE). Это происходит из-за восстановления до Mo (V) или Mo (III).
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Молибден, Мо, 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| серия | Переходные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 6, 5, д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серый металлик | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| номер CAS | 7439-98-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 14 частей на миллион | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ядерной | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 95,94 XNUMX человека | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 145 (190) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 154 м. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Kr] 4d5 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ионизация | 684,3 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1560 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ионизация | 2618 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ионизация | 4480 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| физически | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кристаллическая структура | кубическое тело-центрированное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 10,28 г / см3 (20 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| твердость по Моосу | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | парамагнитный ( = 1,2 10-4) = 1,2 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 2896 К (2623 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 4912 К (4639 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 9,38 · 10-6 m3/ моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 600 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 36 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 6190 м / с | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 18,2 · 106 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 139 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химический | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| состояния окисления | 2, 3, 4, 5, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | −0,152 В (МоО2 + 4e- + 4H+ → Мо + 2 H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 2,16 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| свойства ЯМР | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Цены на молибден
Цена на молибден -> Цены для стратегических металлов

