Теллур, Те, атомный номер 52
Цена, возникновение, добыча и использование теллура
Теллур [tʰɛluːɐ̯] (лат. Tellus «земля») является редким химическим элементом с символом элемента Te и атомным номером 52. В периодической таблице это находится в шестой основной группе, или 16. IUPAC Group и 5. Период и является одним из Chalkogens. Его частота аналогична частоте золота, с которой он также входит в различные соединения, которые встречаются в природе в виде минералов. Кристаллический теллур представляет собой серебристо-белый блестящий металлический полуметалл, который по внешнему виду напоминает олово и сурьму. Он реагирует хрупко на механические нагрузки и поэтому может быть легко измельчен. В химических соединениях с неметаллами он близок по своему поведению к сере и селену, в сплавах и интерметаллических соединениях, однако проявляет очень выраженные (полу) металлические свойства.
история
Теллур был 1782 австрийским химиком и минералогом Францем Иосифом Мюллером фон Райхенштейном (1740-1825) в исследованиях золотых руд с рудника Мариахильф на горе Фацебая в Златне (немецкий Кляйн Шлаттен, Залатна) близ Сибиу (Герман Херманштадт) , Трансильвания, Румыния), которая принесла меньше золота, чем ожидалось. Он узнал о рудах из научного трактата Игназа фон Борна (1742-1791) о пятнистом шпионе в Трансильвании. Spiesglaskönig относится к твердой сурьме, стекло Spies - это старое название минерала Antimonit (Stibnit, Grauss Sb2S3). Фон Борн хранил твердый металл в золотой руде для сурьмы и объяснял низкую доходность комбинации золота с сурьмой. Мюллер фон Райхенштейн противоречил этой точке зрения и в первую очередь придерживался ее за «сульфированный висмут». После дальнейших исследований, результаты которых он опубликовал между 1783 и 1785 в эссе из четырех частей, он также исключил висмут, поскольку металл, в отличие от сурьмы и висмута, практически не реагировал с серной кислотой. Он дал металлической фазе название metallum Problematicum (также Aurum Problematicum или Aurum Paradoxum). Согласно современным знаниям, рядом с твердым теллуром находятся минералы Nagyágit (листья руды, AuPb (Pb, Sb, Bi) Te2-3S6) и Sylvanite (шрифт, (Au, Ag) Te2). Мюллер фон Райхенштейн предположил, что metallum problemmaticum «... возможно, новый, еще не признанный полуметалл» хотел получить свои выводы, однако, только шведский минералог и химик Торбен Олоф Бергман (1735-1784) подтвердил. В 1783 году он отправил образцы руды Бергману на рассмотрение, но не получил окончательных ответов. Бергман умер 1784, и в настоящее время исследования по проблематике с металлом были прекращены.
Только спустя двенадцать лет, в год 1797, Мартин Генрих Клапрот (1743-1817) получил образцы руд от Мюллера фон Райхенштейна в Берлине. Клапрот подтвердил выводы исследований Мюллера фон Райхенштейна и нашел достаточно доказательств для открытия нового элемента. В январе 1798 Клапрот высоко оценил заслуги Мюллера фон Райхенштейна в лекции и приписал ему открытие нового элемента. Поскольку Мюллер фон Райхенштейн не дал элементу никакого имени, Клапрот решил назвать имя Теллур (латинское Tellus: «Земля»):
Чтобы заполнить этот пробел в химической минералогии, я представляю здесь свои эксперименты и опыты с этими драгоценными рудами, главным результатом которых является обнаружение и проверка нового своеобразного металла, к которому я добавляю название Теллур, заимствованное у старой Матери-Земли. "
Оригинальные наконечники образца материала типа населенного пункта Златна, которые имелся у Клапрот, сегодня находятся в Музее естественной истории в Берлине.
Независимо от Мюллера фон Райхенштейна и Клапрот, 1789 обнаружил венгерского химика и ботаника Пола Китайбеля (1757-1817) теллур в исследованиях золотосодержащих руд из шахтерской деревни Надьбёрзсой (Дойч-Пльзень) в Венгрии. Клапрот упомянул в своей опубликованной лекции, однако, только Мюллера фон Райхенштейна, хотя со времен 1796 по рукописи Китайбельс также знал о своих исследованиях. В письме Китаибелю Клапрот заявил, что он утратил содержание рукописи и что он не видел никакой связи со своей работой по разведке руды Мюллер фон Райхенштайн. Наконец, Клапрот окончательно убедил Китайбеля, что открытие теллура следует отнести только к Мюллеру фон Райхенштейну, поскольку он сделал те же наблюдения на новом элементе несколькими годами ранее.
Символ элемента "Te" был предложен 1814 Йенсом Якобом Берцелиусом (1779-1848) и используется до сих пор. Первым исследованием структуры кристаллического теллура с помощью дифракции рентгеновских лучей было 1924.
Вхождение
Теллур является редким элементом; его вклад в земную кору составляет около 0,01 ppm (г / т). Что касается золота, подчиненного серебру, меди, свинцу и висмуту, а также платиновых металлов, то оно редко встречается с достоинством, то есть в элементарной форме в природе.
Твердый теллур относится как минерал к группе элементов, точнее к полу- и неметаллам, и входит в классификацию минералов по Струнцу под номером I / B.03-40 (издание 8) или 1.CC.10 (9. Редакция) и привел Дану под номером 1.3.4.2.
Следы большего количества селена могут содержаться в твердом теллуре (селен). Хотя теллур является редким элементом, известно относительно большое количество минералов, поскольку теллур образует свои собственные минералы, поскольку он редко включается в сульфиды, селениды, сульфаты или селенаты; он слишком велик для этих кристаллических решеток более легких гомологов. И наоборот, два более легких гомолога чаще представляют теллур на его узлах решетки в кристаллических структурах теллурсодержащих минералов.
Теллур проявляет наибольшее сродство к золоту среди всех элементов и поэтому часто встречается в природе в форме теллуридов золота, минералов с теллуридом (Te2) или анионов дителлурида (Te22-). Помимо золота и других драгоценных металлов свинец и висмут образуют более естественные теллуриды, часто сопровождающие (парагенезийцы) достойные металлы и золотые руды.
Более редкими являются минералы с катионами Te4 + в кристаллической структуре, при этом наиболее важный оксид теллура, диоксид теллура TeO2, встречается в двух модификациях как орторомбический теллурит и тетрагональный парателлурит в природе. Другими катионами теллура (IV) являются оксотеллюраты (IV) (теллуриты), содержащие комплексные анионы [TeO3] 2 или [TeO4] 4. Минералы, содержащие катионы Te6 + в форме октаэдрических комплексных анионов [TeO6] 6, встречаются крайне редко, причем минералы 21 в основном содержат медь и свинец. В дополнение к упомянутым минералам в природе существуют минералы теллура со смешанной валентностью, в том числе оксо-теллурат кальция (IV, VI) Carlfriesite CaTe3O8 с соотношением Te4 +: Te6 + 2: 1. [14] [15] TeNUMX и TeNUMX для минералов с минералами Катионы - это вторичные минералы, которые возникли в результате выветривания теллура и теллурида.
Теллурсодержащие минералы не имеют значения для технического производства теллура, так как они редки и месторождений, полезных для разработки, практически нет. В дополнение к типовой местности Златна (Трансильвания, Румыния), к известным минералам, богатым теллуром, относятся Моктезума (Мексика), Крипл-Крик (Колорадо), Калгурли (Австралия) и Калаверас (Калифорния). До настоящего времени (по состоянию на 2012) известны теллурсодержащие минералы 154, из которых пять (дилитий, имгрейт, курилит, штрокайит, протойозеит) еще не были признаны или дискредитированы как независимые минералы Международной минералогической ассоциацией (IMA).
Извлечение и презентация
Теллур вместе с селеном получают в промышленных масштабах исключительно из побочных продуктов крупномасштабного электролитического производства меди и никеля. Полученные анодные суспензии содержат нерастворимые в воде теллуриды и -селениды благородных металлов общей формулы M2Ch (M = Cu, Ag, Au, Ch = Se, Te), которые при температурах выше 500 ° C в атмосфере кислорода (O2) с содой (карбонат натрия Na2CO3) ) реагируют. Катионы благородных металлов (М +), таким образом, восстанавливаются до элементарных металлов (М), которые окисляют анионы теллурида до оксоселлюратов (IV) (TeO32-):
Альтернативно, эту реакцию также можно проводить с азотной кислотой (нитрат натрия NaNO3) в отсутствие воздуха и образования оксидов азота (NO и NO2):
Полученный в результате теллурат натрия (IV) Na2TeO3 затем растворяется в воде, где он реагирует в основном и образует ионы гидротеллурата (IV) HTeO3-. Отделение теллуратов (IV) от аналогично образующихся селенатов (IV) в основном растворе путем нейтрализации с добавлением серной кислоты (H2SO4), которая осаждает в воде практически нерастворимый диоксид теллура TeO2:
Диоксид теллура может быть восстановлен до элементарного теллура в литиях электролизом или химическими средствами путем растворения в концентрированных минеральных кислотах и введения диоксида серы SO2, при этом сера образуется из молекул SO2 (или сульфит-ионов SOxnumx, образующихся из них в растворе). ) и сульфат-ионы (SO32-) образуются:
Процесс зонной плавки используется для получения теллура высокой чистоты (> 99,9%).
Годовое мировое производство теллура увеличилось с 298 тонн в 2013 на 53% до 457 тонн в год 2017, в среднем 382,8 тонн в год (т / год). Основными производителями являются Китай (∅ 220,0 т / год), США (∅ 50,0 т / год), Россия (∅ 35,6 т / год), Швеция (∅ 32,4 т / год), Япония (∅ 31,8 т / год) и Канада (N 13,0 т / а). Обзор объемов производства отдельных стран приведен в таблице. Другие промышленные страны, такие как Германия и Бельгия, могут производить теллур, но данные отсутствуют. [17] Геологическая служба США (USGS) оценивает глобальные запасы теллура в 2019 в тоннах 31.000.
| Земля | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| Китай | 150 | 180 | 210 | 279 | 281 | 220,0 |
| США | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Россия | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Швеция | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Япония | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Канада | 12 | 9 | 9 | 18 | 17 | 13,0 |
| гул | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
изменения
Кристаллический теллур
При стандартных условиях известна только кристаллическая модификация (Te-I или α-Te) теллура, которая называется кристаллическим или металлическим теллуром. Он изотипичен α-селену, то есть имеет одинаковую кристаллическую структуру. В тригональной кристаллической системе в пространственной группе P3121 (№ 152) теллур кристаллизуется с параметрами решетки a = 446 pm и c = 592 pm и тремя формульными единицами в элементарной ячейке (наименьшая единица кристаллической структуры).
Пространственная группа P3121 (№ 152), описанная в соответствии с символикой Германа Могена, объясняет центрирование элементарной ячейки и существующие элементы симметрии. P означает, что решетка Браве примитивна. Информация о центрировании сопровождается существующими элементами симметрии пространственной группы: 31 описывает ось винта тройного порядка (умножение частицы вращением на 120 ° и смещение (перенос) на 1/3 в направлении оси вращения), параллельную кристаллографической оси c ([001] ), 2 описывает двойную ось вращения (умножение на поворот на 180 °), параллельную трем кристаллографическим осям a (<100>), 1 элемент симметрии единственной оси симметрии или идентичности (умножение на вращение на 360 °, так что частица формируется на самом себе) в направлении, перпендикулярном осям a и c (<120>).
Кристаллическая структура содержит только один кристаллографически различимый атом теллура с координатами положения x = 0,2636, y = 0 и z = 1 / 3. Все остальные атомы кристаллической структуры могут быть отнесены к этому атому существующими элементами симметрии пространственной группы. Поскольку атом теллура совпадает в своем положении с двойной осью симметрии пространственной группы (P3121 (№ 152)), он умножается исключительно на тройную винтовую ось (31). Это приводит к образованию спиральных цепочек ковалентно связанных атомов теллура, параллельных оси c. Атомы теллура находятся внутри цепи 284 pm друг от друга, угол связи равен 103,1 °. Ссылки на цепочке выделены красным на иллюстрациях, одна цепочка показана для наглядности синим, с синим атомом на z = 1 / 3, средним синим на z = 2 / 3 и голубым на z = 1 или z = 0 находится. Следовательно, каждый третий атом в цепи является конгруэнтным. Каждая цепь окружена еще шестью цепями. Ван-дер-ваальсовы связи существуют между цепочками с Te-Te-расстояниями 349 pm (показано зелеными пунктирными линиями), которые возникают в результате падения радиуса Ван-дер-Ваальса (2 · 206 pm = 412 pm) атомов теллура. , Для одного атома теллура получается координационное число 6, точнее 2 + 4, поскольку атомы 2 происходят из одной и той же цепи и, следовательно, имеют меньшее расстояние, чем другие 4, от соседних цепей. В качестве координационного многогранника это приводит к искаженному октаэдру (выделено желтым цветом).
Теллур также может кристаллизоваться в космической группе P3221 (# 154) вместо P3121 (# 152). Винтовая ось 32 также дублирует атом, поворачивая его вокруг 120 °, но затем сдвигает его на 2 / 3 вместо 1 / 3 в направлении оси вращения. Это также создает спиральные цепи, которые вращаются по часовой стрелке, а не против часовой стрелки (по оси винта 31) вдоль оси c. Таким образом, кристаллическая структура в пространственной группе P3221 (№ 154) («левая рука») является зеркальным отражением структуры в пространственной группе P3121 (№ 152) («юридическая форма»). Появление зеркальных кристаллических форм называется энантиоморфизмом в кристаллографии.
Кристаллическая система теллура часто упоминается как гексагональная. Гексагональная и тригональная кристаллическая система основана на одной и той же элементарной ячейке, но гексагональная симметрия потребовала бы наличия шестикратной оси симметрии (6, умножение частицы на вращение вокруг 60 °). Кристаллическая структура теллура, однако, содержит только тройную винтовую ось (31) и, таким образом, принадлежит, без сомнения, к нижней симметричной тригональной кристаллической системе.
В экспериментах с высоким давлением с кристаллическим теллуром (Te-I или α-теллур) были обнаружены дополнительные модификации. Указанные диапазоны давлений для стабильности модификаций частично варьируются в литературе:
- Те-II кристаллизуется в моноклинной кристаллической системе в диапазоне давлений от 4 до 6,6 ГПа. C2 / m (№ 12) и P21 (№ 4) упоминаются в литературе в качестве возможных пространственных групп.
- Те-III кристаллизуется в ромбической кристаллической системе и стабилен в диапазоне давлений выше 6,6 ГПа. Для орторомбической модификации существует теоретический расчет в пространственной группе Imma (№ 74).
- Te-IV кристаллизуется в тригональной кристаллической системе в пространственной группе R3m (№ 166) и соответствует структуре β-полония. Он стабилен в диапазоне давлений от 10,6 до 27 ГПа. Расстояния между атомами теллура внутри цепей и до соседних цепей в этой модификации одинаковы и составляют 300 pm, что приводит к более высокой симметрии по сравнению с α-Te.
- Te-V стабильно выше 27 ГПа. Для этой модификации предполагается центрированная решетка с кубическим телом (пространственная группа Im3m (# 229)).
Аморфный теллур
Нестабильная аморфная модификация представляет собой коричневый порошок и может быть получена из теллуровой кислоты (H2TeO3) путем реакции с серной кислотой (H2SO3) или сульфит-ионами (SO32-). Таким образом, сульфит-ионы окисляются до сульфат-ионов (SO42-), а катионы Te4 + восстанавливаются до элементарного теллура:
Аморфный теллур медленно превращается в кристаллическую модификацию при стандартных условиях.
Физические свойства
Кристаллический теллур является прямым полупроводником с шириной запрещенной зоны 0,334 эВ. Как и во всех полупроводниках, электрическая проводимость может быть увеличена путем повышения температуры или воздействия, но это только приводит к небольшому увеличению теллура. Электропроводность и теплопроводность ведут себя зависимо от теллура, то есть анизотропны. Кристаллический теллур - это мягкий (Mohs 2,25) и хрупкий материал, который легко перерабатывать в порошок. При увеличении давления теллур превращается в дальнейшие кристаллические модификации. Выше 450 ° C теллур переходит в красный расплав, а при температурах выше 990 ° C теллур присутствует в виде желтого диамагнитного газа молекул Te2. При температурах выше 2000 ° C молекулы Te2 распадаются на отдельные атомы.
Химические свойства
Кристаллический теллур нерастворим в воде и плохо растворим в минеральных кислотах, соляной кислоте и серной кислоте, а также в щелочах. С другой стороны, он очень хорошо растворяется в азотной кислоте, так как является очень сильным окислителем и окисляет элементарный теллур до теллуратов со стабильной степенью окисления + IV. Теллур плавится, атакует медь, железо и нержавеющую сталь.
В соединениях с неметаллами теллур ведет себя как более легкий член группы, селен. В воздухе он горит зеленым, синим пламенем и превращается в диоксид теллура TeO2:
Теллур самопроизвольно реагирует с галогенами с образованием галогенидов теллура. Примечательно, что в отличие от более легких гомологов селена и серы, теллур также образует термодинамически стабильные йодиды, в том числе йодид теллура TeI со степенью окисления + I. С основными металлами, такими как цинк, он бурно реагирует на соответствующие теллуриды.
Изотоп
Теллур известен массовыми изотопами между 105 и 142. Природный теллур представляет собой смешанный элемент, состоящий из восьми изотопов, из которых пять (122Te, 123Te, 124Te, 125Te, 126Te) являются стабильными. Изотоп 123Te должен теоретически распадаться до 123Sb при захвате электрона. Однако этот распад еще не наблюдался; нижний предел его периода полураспада составляет 9,2 · 1016 лет (квадриллион лет 92). Изотоп 120Te переходит непосредственно в 120Sn посредством двойного захвата электронов. Изотопы 128Te и 130Te превращаются в 128Xe и 130Xe, соответственно, путем испускания бета-излучения (двойной бета-распад).
Основной вклад в природный теллур составляет около трети изотопа 130Te с периодом полураспада 7,9 · 1020 лет, за которым следует изотоп 128Te. Следовательно, средняя атомная масса естественных изотопов теллура равна 127,60, что больше, чем у чистого элемента йода с 126,90, приведенного в периодической таблице. 128Te считается изотопом с самым медленным распадом всех нестабильных изотопов всех элементов. Чрезвычайно медленный распад с периодом полураспада 7,2 · 1024 лет (квадриллион 7 лет, т.е. в килограммах 1 один атом распадается каждые 18 месяцев) можно определить только путем обнаружения продукта распада (128Xe) в очень старых образцах природного теллура.
Из других изотопов основной изомер 121mTe имеет самый длинный период полураспада с днями 154. Также для изотопов 127Te и 129Te периоды полураспада изомеров выше, чем у основного состояния. Наиболее часто используемым индикатором является изотоп 127Te, за которым следует 121Te. Изотопы 127Te и 129Te также встречаются в качестве продуктов деления при ядерном делении в ядерных реакторах.
Использовать
Теллур является технически менее важным элементом, потому что его производство дорого, а другие элементы или соединения часто эквивалентны в использовании. В 2016 году было продемонстрировано термоэлектрическое поведение элементарного, поликристаллического и легированного теллура с высокой добротностью в диапазоне от комнатной температуры до 400 ° C. Элементарный теллур используется в металлургической промышленности в качестве добавки (<1%) к стали, чугуну, сплавам меди и свинца, а также к нержавеющей стали. Он способствует устойчивости к коррозии и улучшает механические свойства и обрабатываемость. Чистый теллур до сих пор редко использовался в качестве полупроводника; теллур в основном используется в полупроводниках соединений II-VI. Теллурид кадмия CdTe - это z. Б. используется в фотодиодах и тонкопленочных солнечных элементах для выработки электричества из света.
Теллурид висмута Bi2Te3 используется в термопарах для выработки электроэнергии в термоэлектрических генераторах (например, в радионуклидных батареях) или в элементах Пельтье для охлаждения.
Комбинации германия GeTe и теллурида сурьмы Sb2Te3 используются в материалах с фазовым переходом как часть оптических накопителей (например, CD-RW) или в новых материалах хранения, таких как память с произвольным доступом с фазовым переходом.
Благодаря высоким показателям преломления стекла из диоксида теллура TeO2 используются вместо кварцевого стекла SiO2 в оптических волноводах.
В микробиологии бесцветный смешанный агар теллурат калия (IV) K2TeO3 используется в качестве селективной питательной среды для обнаружения стафилококков и Corynebacterium diphtheriae. Бактериальные колонии выглядят как маленькие черные сферы, поскольку они превращают катионы Te4 + в элементарный теллур и сохраняют их в своих клетках.
Теллур (или теллурат калия) впервые был использован в медицине 1890 для лечения ночного потоотделения у пациентов с туберкулезом.
Кроме того, небольшие количества теллура используются для вулканизации резины, в детонаторах и для окрашивания стекла и керамики. Соли теллура частично используются, чтобы произвести траву зеленого цвета в фейерверке.
Инструкции по безопасности и токсичность
В растворимой форме теллур является ядовитым элементом для человеческого организма и поэтому классифицировался как ядовитый в прошлом. Однако, поскольку элементарный теллур очень плохо растворяется в воде и собственных кислотах организма, его статус был понижен до опасного. Исследования Нидерландской организации прикладных научных исследований (TNO) показали, что значение LD50 (перорально) для крыс составляет> 5000 мг / кг. Значение 83 мг / кг, приведенное во многих паспортах безопасности из книги Н. Ф. Исмерова «Токсикометрические параметры промышленных токсичных химикатов при однократном воздействии», датированной 1982 годом [26], применимо только к легко растворимым соединениям теллура. Несмотря на это, различные производители продолжают использовать старое значение LD50 для элементарного теллура (порошок) и классификацию токсичности в связи с H-фразой 301 («Токсично при проглатывании»).
Теллур не так токсичен, как селен. Это аналогично соседним элементам 5. Основная группа, где сурьма также менее токсична, чем мышьяк. Если теллур, особенно в форме легкорастворимых соединений теллура, таких как теллураты щелочных металлов (например, Na2TeO3) при проглатывании (перорально) в организме, образуется путем снижения токсического диметилтеллурида (Me2Te: H3C-Te-CH3), который вызывает повреждение крови, печени Может вызвать сердце и почку. Поскольку легко растворимые соединения теллура высвобождают гораздо больше теллура, они также классифицируются как более опасные. Отравление теллуром проявляется в интенсивном запахе чеснока из дышащего воздуха, который вызывается диметилтеллуридом, впервые Кристианом Готтлобом Гмелином, 1824 (для его первых исследований о влиянии теллура на живые существа). Это займет несколько недель, чтобы развиваться и развиваться даже на очень низких уровнях, которые не вызывают серьезных отравлений. Этот запах чеснока, в отличие от настоящего чеснока, нельзя удалить, почистив зубы. Он также оседает в комнате и уходит только через несколько часов. Он также медленно выводится через кожу.
Пыль Tellurst может самопроизвольно воспламениться в воздухе и, при тонком распределении в соответствующей концентрации, может также реагировать взрывно, образуя в каждом случае диоксид теллура TeO2. Как и другие виды металлической пыли, порошок теллура также может вступать во взрывоопасные реакции с такими соединениями галогена, как пентафторид брома BrF5. Максимальная концентрация на рабочем месте (MAK) для теллура не установлена.
доказательство
Элементарный теллур может быть обнаружен в горячей концентрированной серной кислоте (H2SO4) путем окисления теллура с образованием красного катиона Te42 + (тетрателлурическая дикция). Часть серной кислоты восстанавливается в реакции с серной кислотой (H2SO3), которая разлагается из-за высоких температур в воде (H2O) и ее ангидриде двуокиси серы (SO2), которая выделяется в виде газа:
Цвет квадратно-плоского катиона Te42 + обусловлен шестью делокализованными π-электронами, которые поглощают часть видимого света. Оставшиеся непоглощенные световые волны дают дополнительный красный цвет.
Теллурат и теллурит могут быть определены с помощью полярографии, то есть выборочно определены бок о бок. Хотя уровень теллурата составляет -1,66 V, уровень теллурита появляется при -1,22 V (по сравнению с SCE, 0,1 M едкий натр). Оба вида теллура восстанавливаются за один шаг до теллурида. Следы 0,03% теллурата или 0,003% теллурита обнаруживаются таким образом. Значительно сильнее методы атомной спектроскопии. В то время как пламя AAS достигает предела обнаружения 20 мкг / л, это значение намного ниже для графитовой трубки AAS (0,2 мкг / л) и метода гидрида (0,02 мкг / л).
теллур
В соединениях теллур встречается чаще всего в состояниях окисления -II (теллуриды) и + IV (тетрагалогениды, диоксид теллура и теллураты (IV), устаревшие теллуриты). Более редкими являются степени окисления + VI (теллураты (VI)) и + II (дигалогениды), а также -I (дителлуриды) и + I (моногалогениды, известные только как TeI).
Водородные соединения
Теллурный водород H2Te - бесцветный, высокотоксичный газ, образующийся в результате реакции теллуридов (MxTey) с сильными кислотами, такими как соляная кислота HCl. Из элементов (водород и теллур) соединение может быть представлено как сильно эндотермическое соединение только при температурах выше 650 ° C. Растворяется в воде (теллуровая кислота), реагирует кислой, кислотность примерно соответствует фосфорной кислоте. В воздухе водный раствор немедленно разлагается на воду и элементарный теллур.
кислородные соединения
Диоксид теллура (оксид теллура (IV)) TeO2 представляет собой бесцветное кристаллическое твердое вещество и самый важный оксид теллура. Это является результатом сгорания элементарного теллура с воздухом. Это ангидрид слабо амфотерной и нестабильной теллуровой кислоты H2TeO3. Диоксид теллура существует в ромбической (теллурит) и тетрагональной (парателлурит) модификации, которые также встречаются в природе как минералы.
Триоксид теллура (оксид теллура (VI)) TeO3 представляет собой желтое тригональное / ромбоэдрическое кристаллизующееся твердое вещество и ангидрид ортотеллуровой кислоты H6TeO6. Это вытекает из дренажа ортотеллуровой кислоты в результате сильного повышения температуры. Желтый цвет связан с переносом электронов кислорода в теллур («перенос заряда»).
Оксид теллура (оксид теллура (II)) TeO является еще одним, но при стандартных условиях нестабильным оксидом теллура. Он описывается как черное аморфное твердое вещество и реагирует во влажном воздухе с кислородом с образованием более стабильного диоксида теллура TeO2.
Двухклеточный пентоксид (теллур (IV), теллур (VI) оксид) представляет собой смешанный оксид теллура с катионами Te4 + и Te6 +. Кроме триоксида теллура, он является другим продуктом термического разложения ортотеллуровой кислоты и кристаллизуется в моноклинной кристаллической системе.
Теллуратами являются соли ортотеллуровой кислоты H6TeO6 и метателлуровой кислоты H2TeO4 с анионами [TeO6] 6- или [TeO4] 2-. Соли теллуровой кислоты H2TeO3 с анионом [TeO3] 2 - называются теллуратами (IV) (устаревшие теллуриты).
галогеновые соединения
Тетрагалогениды TeX4 с теллуром в степени окисления + IV являются наиболее распространенными галогенидами теллура. Они известны со всеми галогенами (фтор, хлор, бром и йод). Все соединения являются кристаллическими твердыми веществами.
Дигалогениды TeX2 с теллуром в степени окисления + II известны только с хлором, бромом и йодом, они существуют только в газовой фазе.
Моногалогениды TeX существуют из теллура только с йодом в виде йодида теллура TeI. Это единственный известный термодинамически стабильный монойодид халькогенов и темное кристаллическое твердое вещество. Теллур в этом соединении имеет необычную степень окисления + I.
Субгалогениды содержат Те со степенью окисления менее + I. Стабильными представителями являются Te2I, Te2Br и Te3Cl2.
Гексагалиды TeX6 с теллуром в степени окисления + VI известны только как гексафторид теллура TeF6 или пентафторид теллура TeF5Cl. Оба бесцветные газы. Гексафторид теллура является наиболее реакционноспособным гексафторидом халькогена (помимо гексафторида серы SF6 и гексафторида селена SeF6) и является единственным, который гидролизуется в воде.
Кроме того, теллур в степени окисления + IV в водном растворе также является комплексным соединением [TeX6] 2- (X = F-, Cl-, Br-, I-) со всеми ионами галогенидов. За исключением гексафторкомплекса, все остальные имеют совершенно октаэдрическую структуру и могут также осаждаться в виде солей из раствора (например, желтый гексахлоридотеллурат (IV) аммония (NH4) 2 [TeCl6], гексабромидотеллурат (IV) красновато-коричневого аммония (IV) (NH4) 2 [TeBr6] или черный гексайодидотеллурат (IV) цезия Cs2 [TeI6]).
теллуроорганическое соединение
Теллур образует ряд металлоорганических соединений. Однако они очень нестабильны и мало используются в органическом синтезе. В качестве чистых теллурорганических соединений известны формы R2Te, R2Te2, R4Te и R6Te (R каждый представляет собой алкил, арил).
Кроме того, также известны диорганотеллярные дигалогениды R2TeX2 (R = алкил, арил; X = F, Cl, Br, I) и триорганотеллургалогениды R3TeX (R = алкил, арил, X = F, Cl, Br, I).
Tellurpolykationen
Поликатион Те72+ в Те7[Be2Cl6]
Путем осторожного окисления теллура, в дополнение к уже упомянутому Te42 +, можно получить многочисленные поликатионы теллура Tenx + и кристаллизовать их с подходящим противоионом. Противоион должен быть слабым основанием Льюиса, поскольку поликатионы теллура являются относительно сильными кислотами Льюиса. Подходящими окислителями часто являются галогениды переходных металлов, которые при температурах обычно 200 ° C дают непосредственно желаемое соединение:
Часто кристаллизация проходит успешно в условиях химического транспорта, но иногда необходимо использовать безводные растворители, такие как хлорид олова или тетрабромид кремния. В некоторых случаях расплавленные соли также являются подходящими реакционными средами.Если галогенид металла не является подходящим окислителем, как это обычно происходит с галогенидами элементов основной группы, соответствующие тетрагалогениды теллура могут быть использованы в качестве окислителей:
Варьируя противоион и реакционную среду, можно представить широкий спектр поликатионов; Смешанные поликатионы селена и теллура также доступны путем соответствующего выбора реагентов синтеза. В дополнение к показанным поликатионам в виде цепочек или полос, существуют также изолированные поликатионы, такие как Te62 +, Te64 + и Te84 +.
Цена теллура
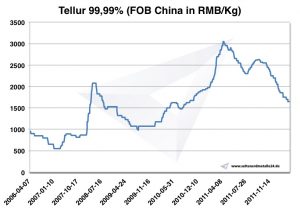
Диаграмма теллура 2006-2011
Цены на теллур -> цены на стратегические металлы










![{\ mathrm {8 \ Te \ + \ 2 \ UBr_ {5} \ longrightarrow \ Te_ {8} [U_ {2} Br _ {{10}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/766123b2cbd2af42e846172c00731419fb95bc1b)
![{\ mathrm {13 \ Te \ + \ TeCl_ {4} \ + \ 4 \ BeCl_ {2} \ longrightarrow \ 2 \ Te_ {7} [Be_ {2} Cl_ {6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)
