Цирконий, Zr, атомный номер 40
Цирконий цена, возникновение, добыча и использование
Цирконий, часто тоже цирконий, является химическим элементом с символом элемента Zr и порядковым номером 40. Его название происходит от циркона, наиболее распространенного минерала циркония. В периодической таблице это находится в 5. период; это второй элемент 4. Группа (устаревшая подгруппа 4) или группа титанов. Цирконий является очень стойким к коррозии тяжелым металлом. Биологические функции неизвестны; он присутствует в небольших количествах (4 мг / кг) в организме человека и не токсичен.
Важный цирконийсодержащий минерал циркон (Zr [SiO4]) с древних времен известен как драгоценный камень. Цирконий как элемент был обнаружен Мартином Генрихом Клапротом в 1789 году в образце минерального циркона с Цейлона и назван в его честь. Металл был впервые представлен в 1824 году Йенсом Якобом Берцелиусом путем сокращения К.2ZrF6 с калием. Для этого он нагрел «Смесь фтористоводородного циркония с калием в железной трубе». После обработки водой, сушки и продолжительного нагревания разбавленной соляной кислотой Берцелиус получил «Кусковой порошок, который выглядит как угольно-черный» был и только «Сжимая полировочной сталью темно-серый цвет и сияние» получила. С другой стороны, правильная атомная масса не могла быть определена до 1924 года, потому что, помимо ошибок в проведении экспериментов, не было известно, что цирконий всегда содержит небольшое количество гафния. Без этой информации измерения всегда давали слишком высокую атомную массу. Первое практическое применение циркония было в качестве бездымный порох.
Вхождение
Цирконий встречается в земной коре с содержанием около 0,016%. В списке упорядоченных по частоте элементов цирконий указан в 18. Место и чаще встречается, чем более привычные элементы хлора и меди. Хотя он очень широко распространен, его обычно можно найти только в очень небольших количествах и в очень маленьких кристаллах (обычно около 0,1 мм). Поэтому цирконий считался редким в древние времена. Цирконий встречается в основном в силикатных интрузивных породах, таких как гранит. Это не прибывает достойно, но только в некоторых полезных ископаемых, особенно как циркон (ZrSiO4) и Бадделеит (ZrO2) и более редкий красный эвдиалит (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) Связанный впереди. Это почти всегда связано с гафнием. Из-за высокой температуры плавления, равной 2550 ° C, высокой твердости и низкой реакционной способности, цирконий является старейшим минералом, который можно найти на Земле, и его можно использовать для определения радиометрического возраста на основе встроенных изотопов урана и тория.
В качестве сырья обычно используются вторичные отложения, так называемые мыльные отложения. Это происходит, когда окружающая порода выветривается и остается только особо устойчивый к погодным условиям циркон. Другие подобные отложения могут возникнуть из-за водных потоков, которые вымывают кристаллы циркония и вымывают их в других местах. С другой стороны, первичные месторождения обычно имеют слишком низкое содержание циркония для рентабельной добычи.

Временное развитие продвижения циркона
Наиболее важные месторождения циркония находятся в Австралии, США и Бразилии. При извлекаемых запасах в 38 миллионов тонн мировое годовое производство циркониевых минералов 2006 составило 920.000 тонн (в пересчете на цирконий). Из них только около 5% перерабатываются в металл и сплавы. Основными странами-производителями были 2006, безусловно, Австралия и Южная Африка.
Извлечение и презентация
Цирконий, наиболее распространенное сырье циркония, необходимо сначала преобразовать в диоксид циркония перед дальнейшей обработкой. Для этого циркон кипятят в расплаве гидроксида натрия (щелочное расщепление). Затем диоксид циркония реагирует с коксом в дуге с образованием карбонитрида циркония (углерод и азотсодержащий цирконий), а затем с хлором с образованием тетрахлорида циркония.

Прямое восстановление диоксида циркония углеродом (как в доменном процессе) невозможно, так как образовавшиеся карбиды очень трудно отделить от металла. Вместо этого тетрахлорид циркония восстанавливается до металлического циркония в так называемом процессе Кролла с магнием в атмосфере гелия.

Процесс Ван-Аркеля-де-Бура используется для получения более чистого циркония. При нагревании в вакууме цирконий сначала реагирует с йодом с образованием иодида циркония (IV). Он снова распадается на цирконий и йод на горячей проволоке:

Тетраиодид циркония образуется из циркония и йода при 200 ° C; он снова распадается при 1300 ° C.
Цирконий и гафний нельзя разделить простым химическим способом. Поэтому даже этот высокочистый цирконий все еще содержит гафний. Поскольку для многих применений в реакторной технике важно, чтобы цирконий больше не содержал гафний, процессы разделения этих двух металлов играют важную роль. Одной из возможностей являются методы экстракции, в которых используется различная растворимость соединений циркония и гафния в специальных растворителях. Часто используют тиоцианаты и их различную растворимость в метилизобутилкетоне. Другими возможностями являются ионообменники или фракционная перегонка подходящих соединений.
Свойства
Физические свойства

Кристаллическая структура α-циркония
Цирконий представляет собой серебристый блестящий тяжелый металл (плотность 6,501 г / см3 при 25 ° C) внешне напоминает сталь. Металл кристаллизуется в двух разных модификациях, в которых он может быть преобразован при изменении температуры. Ниже 870 ° C кристаллизуется α-цирконий в гексагональной кристаллической системе (гексагональная плотная сферическая упаковка, тип магния) в пространственной группе 6/ ммм с параметрами сетки a = 323 pm и c = 514 pm, а также две формульные единицы на элементарную ячейку. При 870 ° C кристаллическая структура меняется на кубо-центрированную β-структуру (вольфрамового типа) с пространственной группой  а параметр решетки a = 361 пм.
а параметр решетки a = 361 пм.
Цирконий относительно мягкий и гибкий. Он может быть легко обработан путем прокатки, ковки и ковки. Однако он становится хрупким и трудным для обработки из-за низкого содержания водорода, углерода или азота в металле. Электропроводность не такая хорошая, как у других металлов. Это только около 4% от меди. Цирконий, напротив, является хорошим проводником тепла. Температура плавления и температура кипения несколько выше по сравнению с более легким гомологом титана (температура плавления: титан: 1667 ° C, цирконий: 1857 ° C). Кроме того, электрическая и теплопроводность лучше. Ниже 0,55 K цирконий становится сверхпроводящим.
Свойства циркония и более тяжелого гомолога гафния очень похожи из-за сокращения лантаноидов. Для этого требуются аналогичные атомные радиусы (Zr: 159 мкм, Hf: 156 мкм) и, следовательно, аналогичные свойства. Два металла значительно различаются по своей плотности (Zr: 6,5 г / см3, Hf: 13,3 г / см3).
Важным свойством, из-за которого цирконий приобрел большое значение в конструкции реакторов, является его малое сечение захвата нейтронов. В этом качестве цирконий также сильно отличается от гафния. Это делает необходимым сложный процесс разделения для этих приложений.
Химические свойства
Цирконий - основной металл, который вступает в реакцию со многими неметаллами, особенно при высоких температурах. В основном в виде порошка он горит белым пламенем с образованием диоксида циркония, в присутствии азота также до нитрида циркония и оксинитрида циркония. Компактный металл вступает в реакцию с кислородом и азотом только при белом нагреве. При повышенном давлении цирконий реагирует с кислородом даже при комнатной температуре, так как образовавшийся оксид циркония растворим в расплавленном металле.
Цирконий пассивируется на воздухе тонким очень плотным слоем оксида циркония и поэтому инертен. Поэтому он нерастворим почти во всех кислотах, только царская водка и фтористоводородная кислота атакуют цирконий при комнатной температуре. Водные основания не реагируют с цирконием.
Изотоп
Есть много изотопов циркония между 78Zr и 110Зр известен. Природный цирконий представляет собой смешанный элемент, состоящий из пяти изотопов. Это 90Zr, который встречается наиболее часто с долей 51,45% природного циркония, и более тяжелые изотопы 91Zr (11,32%), 92Zr (17,19%), 94Zr (17,28%) и 96Zr с долей 2,76%. 96Zr - единственный природный изотоп, который является слаборадиоактивным; он распадается с периодом полураспада 24 · 1018 Годы под двойным бета-распадом 96Мо Изотоп 91Zr может быть обнаружен с помощью ЯМР-спектроскопии.
Использовать
 Важным применением циркония являются урановые оболочки топливных элементов Циркалоя на атомных электростанциях. Этот сплав содержит приблизительно 90% циркония и небольшое количество олова, железа, хрома или никеля, но не должен содержать гафний. Причиной выбора этого элемента является уже описанное низкое поперечное сечение захвата для тепловых нейтронов с одновременно высокой коррозионной стойкостью, что делает его также пригодным в качестве строительного материала для химических установок, особенно для деталей специального оборудования, таких как клапаны, насосы, трубы и теплообменники. Как легирующая добавка к стали, она также повышает коррозионную стойкость. Хирургические инструменты изготовлены из соответствующих сплавов.
Важным применением циркония являются урановые оболочки топливных элементов Циркалоя на атомных электростанциях. Этот сплав содержит приблизительно 90% циркония и небольшое количество олова, железа, хрома или никеля, но не должен содержать гафний. Причиной выбора этого элемента является уже описанное низкое поперечное сечение захвата для тепловых нейтронов с одновременно высокой коррозионной стойкостью, что делает его также пригодным в качестве строительного материала для химических установок, особенно для деталей специального оборудования, таких как клапаны, насосы, трубы и теплообменники. Как легирующая добавка к стали, она также повышает коррозионную стойкость. Хирургические инструменты изготовлены из соответствующих сплавов.
Поскольку цирконий реагирует с небольшими количествами кислорода и азота, его можно использовать в качестве геттерного материала в лампах накаливания и вакуумных системах для поддержания вакуума. Это свойство также используется в металлургии для удаления из стали кислорода, азота и серы.
Из-за его способности излучать очень яркий свет при сжигании, он использовался в дополнение к магнию в качестве вспыхивающего порошка. В отличие от магния, цирконий имеет то преимущество, что не курит. Эта функция также используется в фейерверках и сигнальных огнях.
Цирконий излучает искру при попадании на металлические поверхности и легко воспламеняется. Военные используют это в некоторых типах боеприпасов, таких как специальные боеприпасы для дробовика Dragon's Breath и американо-американская универсальная планирующая бомба AGM-154 JSOW. В пленочной технологии этот эффект используется для непиротехнических воздействий, например, пули на металлические поверхности.
Цирконий-ниобиевые сплавы являются сверхпроводящими и остаются таковыми даже при сильных магнитных полях. Поэтому они используются для сверхпроводящих магнитов.
Помимо алюминия, содержащего квасцы, для «белого дубления» кож используются соли циркония.
безопасности
Нет известных токсических эффектов циркония и его соединений. Из-за плотного оксидного слоя компактный цирконий не воспламеняется. С другой стороны, в виде порошка он может начать гореть при нагревании на воздухе. Циркониевые пожары очень опасны, так как их нельзя использовать для тушения воды (энергичная реакция с образованием водорода), а также углекислого газа или галонов. Циркониевые пожары должны быть погашены металлическими огнетушителями (класс D) или сухим песком.
доказательство
При использовании Alizarin Red-S циркониевая кислота образует характерное красно-фиолетовое соединение (окрашенное озеро), которое исчезает при добавлении ионов фтора с образованием фторокомплекса циркония. Эта реакция может служить качественным обнаружением как циркония, так и фтора. Поскольку даже небольшое количество фтора (и других анионов) мешают, это обнаружение не подходит для анализа минералов. Кроме того, некоторые другие органические соединения, такие как танин, купферрон, фениларсоновая кислота, оксин или ксиленоловый апельсин, подходят в качестве реагента для обнаружения. Другим характерным соединением является хлорид циркония ZrOCl2 · 8 H2О, который кристаллизуется в типичных иглах. В современном анализе цирконий может быть обнаружен атомно-абсорбционной спектрометрией (ААС) или масс-спектрометрией (также по изотопной картине).
Одной из возможностей для количественного анализа является осаждение труднорастворимого гидроксида циркония аммиаком и последующее прокаливание до диоксида циркония.

- Осаждение гидроксида
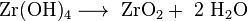
- Передача в форму для взвешивания
Связи
В качестве основного металла цирконий образует множество соединений. Большинство соединений циркония представляют собой соли. Они часто очень стабильны и имеют высокую температуру плавления. Степень окисления + IV является предпочтительной и наиболее стабильной. Но есть также соединения в степенях окисления от + III до + I и в комплексах даже в состояниях 0, -I и -II.
диоксид циркония
 Наиболее важным соединением циркония является диоксид циркония ZrO.2очень устойчивый и тугоплавкий оксид. Диоксид циркония используется для производства огнеупорных футеровок в тиглях и печах. Однако, чтобы использовать его, его необходимо стабилизировать кальцием, иттрием или магнезией для стабилизации кубической высокотемпературной фазы. Кроме того, он используется в качестве абразива и из-за белого цвета в качестве белого пигмента для фарфора.
Наиболее важным соединением циркония является диоксид циркония ZrO.2очень устойчивый и тугоплавкий оксид. Диоксид циркония используется для производства огнеупорных футеровок в тиглях и печах. Однако, чтобы использовать его, его необходимо стабилизировать кальцием, иттрием или магнезией для стабилизации кубической высокотемпературной фазы. Кроме того, он используется в качестве абразива и из-за белого цвета в качестве белого пигмента для фарфора.
Кристаллы диоксида циркония бесцветны и имеют высокий показатель преломления. Вот почему они используются под названием цирконий как искусственный драгоценный камень и заменяют алмазы.
Если оксид циркония смешивают с оксидом иттрия, появляются дополнительные возможности применения. При трехпроцентном содержании оксида иттрия ZrO2 стабилизируется в искаженной структуре флюорита. В результате он действует как проводник для ионов кислорода при температурах выше 300 ° C. Важным применением для этого является лямбда-зонд в автомобилях, который используется для измерения содержания кислорода в выхлопных газах для катализатора. При содержании иттрия 15% диоксид циркония излучает очень яркий белый свет при температуре 1000 ° C. Это используется в так называемом применении лампы Нернста. Поскольку иттрий-циркониевая керамика обладает чрезвычайно высокой вязкостью разрушения, они используются, например, в стоматологии в качестве высокостабильной конструкции коронки и мостика, в искусственных тазобедренных суставах и зубных имплантатах или в качестве соединительного элемента в телескопах. При этом они все чаще заменяют золото и другие металлы в своей функции.
Диоксид циркония также часто используется для изготовления шариковых подшипников. Специально для обоймы подшипников ZrO2 большое преимущество в том, что коэффициент теплового расширения близок к таковому у стали. Другая техническая керамика, такая как нитрид кремния, обычно имеет значительно более низкий коэффициент теплового расширения.
галогениды
С галогенами фтором, хлором, бромом и йодом цирконий образует несколько рядов соединений. Все галогены представляют собой соединения формы ZrX4ZrX3 и ZrX2 известный. Кроме того, существуют хлориды, бромиды и йодиды в форме ZrX. Тетрагалогениды формы ZrX являются наиболее стабильными.4, Известно, что ни один из галогенидов циркония не имеет важных применений, причем хлориды циркония являются промежуточными при получении чистого циркония.
Другие соединения циркония
Силикат циркония, ZrSiO4, более известный под названием минерала циркон, является наиболее распространенным соединением циркония, встречающимся в природе. Это важнейший источник циркония и его соединений. Циркон также используется как драгоценный камень.
Органические соединения циркония в большинстве своем нестабильны. Органические комплексы циркония, т. Н. цирконоценыс такими радикалами, как циклопентадиенил. Они технически важны в качестве катализатора полимеризации алкенов, особенно для производства полипропилена. Другое применение органического соединения циркония находится в hydrozirconation, Это алкены используют реагент Шварца Cp2ZrHCl (Cp = циклопентадиенил) превращается в спирты или галогенированные углеводороды. В реакции концевых алкинов с реагентом Шварца, возникающих в тризамещенных двойных связях гидроцирконирования, дальнейшая реакция с электрофильным реагентом приводит к транс-функционализированным алкенам с высокой стереохимической чистотой.
Алюминиево-циркониевые комплексы могут быть использованы в качестве антиперспиранта.
Гексафторидозирконат калия (IV) К2ZrF6 (CAS: 16923-95-8) может использоваться для отделения циркония от гафния.
Карбонат циркония существует как основной комплекс. Он используется, среди прочего, в бумажной промышленности.
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Цирконий, Zr, 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| серия | Переходные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 4, 5, д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| номер CAS | 7440-67-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 0,021% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ядерной | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 91,224 XNUMX человека | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 155 (206) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 148 м. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Kr] 4d2 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ионизация | 640,1 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1270 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ионизация | 2218 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ионизация | 3313 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| физически | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| изменения | два (α- / β-Zr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кристаллическая структура | гексагональный; кубический> 1140 К (867 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 6,501 г / см3 (25 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| твердость по Моосу | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | парамагнитный ( = 1,1 10-4) = 1,1 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 2130 К (1857 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 4682 К (4409 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 14,02 · 10-6 m3/ моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 590,5 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 16,9 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| упругость паров | 0,00168 Па при 2125 К. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 4650 (long.), 2250 (trans.) M / s при 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 270,0 Дж / (кг · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 2,36 · 106 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 22,7 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химический | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| состояния окисления | 4, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | −1,553 В (ZrO2 + 4 H.+ + 4 е- → Zr + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 1,33 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| свойства ЯМР | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Цирконий цены
Цена на цирконий -> цены на стратегические металлы


