Галлий, Ga, атомный номер 31
Галлий - Цена галлия, возникновение, добыча, использование
Общий
галлий представляет собой редко встречающийся химический элемент с символом элемента Ga и атомным номером 31. В периодической таблице он находится в 4-м периоде и является третьим элементом 3-й основной группы (группа 13) или группы бора. Это серебристо-белый металл, который легко превращается в жидкость. Галлий кристаллизуется не в одной из кристаллических структур, которые часто встречаются в металлах, а в его наиболее стабильной модификации в орторомбической структуре с димерами галлия. Кроме того, известны шесть других модификаций, которые образуются в особых условиях кристаллизации или под высоким давлением. По своим химическим свойствам металл очень похож на алюминий.
В природе галлий встречается лишь в незначительной степени и в основном в виде примеси в алюминиевых, цинковых или германиевых рудах; Минералы галлия очень редки. Соответственно, его также получают как побочный продукт при производстве алюминия или цинка. Большая часть галлия перерабатывается в полупроводниковый арсенид галлия, который в основном используется для изготовления светодиодов.
Вхождение
Галлий - редкий элемент на Земле, с содержанием 19 ppm в континентальной коре, его содержание сравнимо с литием и свинцом. Он не встречается в элементарной форме, а только в связанной форме, главным образом в алюминиевых, цинковых или германиевых рудах. Наиболее богатые галлием руды включают бокситы, руды цинковой обманки и германит.
Содержание галлия в основном низкое, бокситы, обнаруженные в Суринаме с самым высоким известным содержанием, содержат только 0,008% галлия. Мировые запасы галлия в бокситах составляют 1,6 · 106 По оценкам, тонны. В германите встречаются более высокие содержания галлия - до 1%. Только на руднике Апекс в американском штате Юта руды обнаружены настолько высоко, что была предпринята попытка добычи галлия. Однако через короткое время это не удалось по причинам прибыльности.
Известны лишь несколько минералов галлия, среди которых галлит (CuGaS), обнаруженный в основном в Цумебе в Намибии.2), Зёнгейт (Ga (OH)3) и цумгаллит (GaO (OH)).
Извлечение и презентация
Галлий получается как побочный продукт при производстве алюминия из бокситов по способу Байера. Смесь алюмината натрия и галлата натрия, растворенная в растворе гидроксида натрия, служит исходным продуктом. Галлий можно отделить от алюминия с помощью различных процессов. Одной из возможностей является фракционная кристаллизация с помощью диоксида углерода, при этом гидроксид алюминия сначала осаждается, а более растворимый галлат натрия накапливается в растворе гидроксида натрия. Гидроксид галлия осаждается только после дальнейших стадий процесса в смеси с гидроксидом алюминия. Затем смесь растворяют в растворе гидроксида натрия и электролизом получают галлий. Поскольку этот процесс является энергоемким и трудоемким, он используется только в странах с низкими затратами, таких как Китайская Народная Республика.
Галлий также можно получить непосредственно из раствора гидроксида натрия электролизом. Для этого используются ртутные катоды, амальгама галлия образуется во время электролиза. Также в раствор можно добавить амальгаму натрия.
С помощью специальных гидроксихинолинов в качестве хелатирующих лигандов можно извлечь галлий из каустической соды с помощью керосина и таким образом отделить его от алюминия. Другие элементы, которые также экстрагируются, можно отделить разбавленными кислотами. Оставшееся соединение галлия затем растворяют в концентрированной соляной или серной кислоте и электролитически восстанавливают до металла.
Очень чистый галлий требуется для многих технических применений; например, для полупроводников он может содержать только стомиллионную долю посторонних веществ. Возможные методы очистки: вакуумная перегонка, фракционная кристаллизация или зонная плавка.
Количество произведенного галлия невелико, в 2008 году мировое первичное производство составило 95 тонн. Еще одним важным источником является переработка отходов, содержащих галлий, из которых в 2008 году было извлечено еще 135 тонн галлия. Основными странами-производителями галлия являются Китайская Народная Республика, Германия, Казахстан и Украина, а также Соединенные Штаты, Япония и Великобритания.
В лабораторных масштабах галлий можно получить электролизом раствора гидроксида галлия в растворе гидроксида натрия на платиновых или вольфрамовых электродах.
Свойства
Физические свойства
Галлий - серебристо-белый мягкий (твердость по Моосу 1,5) металл. Он имеет необычно низкую для металлов температуру плавления, которая составляет 29,76 ° C. После ртути и цезия это металл с самой низкой температурой плавления, которая также намного ниже, чем у соседних элементов алюминия и индия. Вероятно, это связано с необычной кристаллической структурой, которая, в отличие от структур других металлов, не обладает высокой степенью симметрии и поэтому не очень стабильна. Поскольку температура кипения сравнительно высока при 2204 ° C, галлий имеет необычно большую площадь, в которой он находится в жидком состоянии. Из-за трудностей кристаллизации жидкий галлий можно легко охладить ниже точки плавления (переохлаждение) и внезапно кристаллизовать, когда образуются зародыши кристаллизации.
Подобно кремнию, некоторым другим элементам и воде, галлий имеет аномалию плотности; его плотность в жидком состоянии примерно на 3,2% выше, чем в твердом. Это типично для веществ, имеющих молекулярные связи в твердом состоянии.
Галлий диамагнитен в твердом состоянии, но становится парамагнитным в жидком состоянии ( = 2,4 10-6 при 40 ° C)
= 2,4 10-6 при 40 ° C)
Для его структур характерно образование галлий-галлиевых связей. Известны различные модификации, которые образуются при различных условиях кристаллизации (четыре известные модификации, от α- до δ-галлия, при нормальном давлении) и под давлением (всего три дополнительных модификации высокого давления, Ga-II, Ga-III, Ga-IV). Наиболее стабильной модификацией при комнатной температуре является α-галлий, который кристаллизуется в ромбической слоистой структуре. Два атома, связанные друг с другом ковалентной связью, образуют димер. Каждый атом галлия также соседствует с шестью другими атомами других димеров. Между отдельными димерами существуют металлические связи. Димеры галлия настолько стабильны, что первоначально сохраняются даже при плавлении, а также могут быть обнаружены в газовой фазе.
Дальнейшие модификации происходят во время кристаллизации переохлажденного жидкого галлия. При -16,3 ° C образуется β-галлий, который имеет моноклинную кристаллическую структуру. В структуре присутствуют параллельные зигзагообразные цепочки атомов галлия. Если кристаллизация происходит при температуре –19,4 ° C, образуется тригональный δ-галлий, в котором, по сравнению с α-бором, есть искаженные икосаэдры, состоящие из двенадцати атомов галлия. Они связаны друг с другом через отдельные атомы галлия. При -35,6 ° C окончательно образуется γ-галлий. В этой ромбической модификации трубки сформированы из соединенных между собой Ga7Кольца посередине линейной цепочки других атомов галлия.
Если галлий находится под высоким давлением при комнатной температуре, различные модификации высокого давления образуются одна за другой при повышении давления. Кубическая модификация галлия-II устойчива выше 30 кбар, в которой каждый атом окружен еще восемью. Если давление увеличить до 140 кбар, металл теперь кристаллизуется в виде тетрагонального галлия-III со структурой, которая соответствует структуре индия. Если давление увеличить до примерно 1200 кбар, в конечном итоге образуется гранецентрированная кубическая структура галлия IV.
Химические свойства
По химическим свойствам галлий аналогичен алюминию. Таким образом, галлий пассивируется за счет образования плотного оксидного слоя в воздухе и не вступает в реакцию. Только в чистом кислороде при высоком давлении металл горит ярким пламенем с образованием оксида. Точно так же он не реагирует и с водой, поскольку здесь образуется нерастворимый гидроксид галлия. С другой стороны, если галлий сплавлен с алюминием и является жидким при комнатной температуре из-за понижения точки плавления, он очень бурно реагирует с водой. Галлий также быстро реагирует с галогенами с образованием соответствующих солей GaX.3.
Галлий амфотерный и растворим как в кислотах, так и в основаниях с выделением водорода. В кислотах, таких как алюминий, образуются соли с Ga.3+Ионы в основаниях галлатах формы [Ga (OH)4]-. Он медленно растворяется в разбавленных кислотах и быстро в царской водке и концентрированной каустической соде. Галлий пассивируется азотной кислотой.
![\ mathrm {2 \ NaOH + 2 \ Ga + 6 \ H_2O \ rightarrow 2 \ Na [Ga (OH) _4] + 3 \ H_2 \ uparrow}](https://upload.wikimedia.org/wikipedia/de/math/7/e/6/7e633a1c6ed8f76b3ebfabbcaba5e544.png)
- Реакция галлия с едким натром
Большинство металлов подвержены воздействию жидкого галлия, поэтому его можно хранить только в емкостях из кварца, стекла, графита, оксида алюминия, вольфрама до 800 ° C и тантала до 450 ° C.
Изотоп
Всего между ними 30 изотопов галлия. 56Га и 86Известны Ga и семь других изомеров ядра. Из них два 69Га и 71Ga стабильны и встречаются также в природе. В природном изотопном составе преобладает 69Ga с 60,12%, 39,88% составляют 71Ga. Нестабильных изотопов 67Ga имеет самый длинный период полураспада - 3,26 дня, другие периоды полураспада колеблются от секунд до максимум 14,1 часов. 72Калибр
Два изотопа галлия, 67Ga и короткоживущий с периодом полураспада 67,71 мин. 68Ga используются в ядерной медицине как индикаторы для позитронно-эмиссионной томографии. 67Ga производится на циклотроне, а при производстве 68Циклотрон не нужен. Вместо этого более долгоживущий изотоп германия 68Ge облучением 69Ga генерируется протонами. Это разваливается 68Га, в результате 68Ga можно извлечь в генераторе галлия-68. Для исследований галлий обычно связывается в комплекс с сильно хелатирующим лигандом, таким как 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA).
Использовать
Из-за редкости этого элемента галлий используется лишь в ограниченном объеме. Из большей части производимого галлия получают различные соединения галлия. На сегодняшний день наиболее экономически важными являются те, которые содержат элементы 5-й основной группы, особенно арсенид галлия, который, помимо прочего, требуется для солнечных элементов и светодиодов. В 2003 году для этой цели было использовано 95% произведенного галлия. Он также служит материалом для легирования кремния (p-легирование).
Большой температурный диапазон, в котором элемент является жидкостью, и низкое давление пара одновременно используются для создания термометров. Галлиевые термометры можно использовать до температуры 1200 ° C. Жидкий галлий можно использовать в качестве барьерной жидкости для измерения объема газов при более высоких температурах, а также в качестве жидкого электродного материала при экстракции сверхчистых металлов, таких как индий.
Галлий обладает высокой смачиваемостью и хорошей отражательной способностью, поэтому его используют в качестве покрытия для зеркал. Он также используется в плавленых сплавах, в теплообменниках ядерных реакторов и в качестве замены ртути в лампах.
Сплавы галлия с другими металлами имеют различное применение. Магнитные материалы создаются путем легирования гадолинием, железом, иттрием, литием и магнием. Сплав с ванадием в составе V3Ga - это сверхпроводник со сравнительно высокой температурой перехода, равной 16,8 К. В ядерном оружии он легирован плутонием для предотвращения фазовых переходов. Многие сплавы галлия, такие как Галинстан, являются жидкими при комнатной температуре и могут заменить токсичную ртуть или очень химически активные натрий-калиевые сплавы.
доказательство
Галлий можно качественно обнаружить с помощью различных типичных цветовых реакций. К ним относятся реакция с родамином B в бензоле, который флуоресцирует от оранжево-желтого до красно-фиолетового при добавлении галлия, морин, который показывает зеленую флуоресценцию, как в реакции с алюминием, и гексацианидоферрат калия (III), с галлием - белый осадок гексацианидоферрата галлия (III ) формы. Кроме того, возможно спектроскопическое обнаружение по характерным фиолетовым спектральным линиям при 417,1 и 403,1 нм.
Количественные доказательства могут быть получены с помощью комплексометрического титрования, например, с этилендиаминтетрауксусной кислотой или с помощью атомно-абсорбционной спектрометрии.
Токсикология и биологическое значение
Нет токсикологических данных для металлического галлия; однако он оказывает разъедающее действие на кожу и слизистые оболочки. Соединения нитрата галлия (III) Ga (NO3)3 и оксид галлия (III) Ga2O3 обладают оральным LD50Значения в граммах: 4,360 г / кг для нитрата и 10 г / кг для оксида. Поэтому галлий считается малотоксичным и, насколько известно, не играет роли в организме человека в качестве микроэлемента.
Связи
В соединениях галлий встречается почти исключительно в степени окисления +3. Кроме того, известны редкие и в основном очень нестабильные соединения галлия (I), а также те, которые содержат как одно-, так и трехвалентный галлий (формально соединения галлия (II)).
Соединения с элементами азотной группы
Наиболее технически важными соединениями галлия являются соединения с элементами группы азота. Нитрид галлия, фосфид галлия, арсенид галлия и антимонид галлия являются типичными полупроводниками (полупроводники III-V) и используются для транзисторов, диодов и других компонентов в электронике. В частности, светодиоды разного цвета выпускаются как соединения галлий-азотных групп. Цвет, который зависит от ширины запрещенной зоны, можно отрегулировать, изменив соотношение анионов или заменив галлий алюминием или индием. Арсенид галлия также используется для солнечных батарей. В частности, они используются в спутниках, поскольку арсенид галлия более устойчив к ионизирующему излучению, чем кремний.
галогениды
Галогениды галлия формы GaX3 по многим свойствам аналогичны соответствующим соединениям алюминия. За исключением фторида галлия (III), они встречаются в виде димеров в структуре бромида алюминия. Хлорид галлия (III) - единственный галогенид второстепенного экономического значения. Он используется в качестве кислоты Льюиса в реакциях Фриделя-Крафтса.
Дальнейшие связи
Как и оксид алюминия, оксид галлия (III) представляет собой бесцветное тугоплавкое твердое вещество. Он существует в пяти различных модификациях, из которых кубическая β-модификация является наиболее стабильной.
Органические соединения галлия существуют как Gallane GAR3, Gallylene GAR и как высшие галанысодержащие галлий-галлиевые связи. Как и многие другие металлоорганические соединения, они неустойчивы к воздуху и гидролизу. Одним из немногих органических соединений галлия, имеющих экономическое значение, является триметилгаллий, который используется в качестве легирующего реагента и для производства тонких слоев арсенида галлия и нитрида галлия при металлоорганической газофазной эпитаксии.
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Галлий, Ga, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| серия | металлы | ||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 13, 4, стр. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||||||||||
| номер CAS | 7440-55-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 14 частей на миллион | ||||||||||||||||||||||||||||||||||||||||||||||||
| ядерной | |||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 69,723 XNUMX человека | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 130 (136) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 122 м. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ван-дер-Ваальса радиус | 187 м. | ||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Ar] 3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ионизация | 578,8 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1979,3 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ионизация | 2963 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| физически | |||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | ||||||||||||||||||||||||||||||||||||||||||||||||
| изменения | семь | ||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 5,904 г / см3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| твердость по Моосу | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | диамагнитный ( = -2,3 10-5) = -2,3 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 302,91 К (29,76 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 2477 К (2204 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 11,80 · 10-6 m3/ моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 256 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 5,59 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 2740 м / с на 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 371 Дж / (кг · К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | о 7,14 · 106 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 29 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Химический | |||||||||||||||||||||||||||||||||||||||||||||||||
| состояния окисления | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | −0,53 В (Ga3+ + 3 е- → га) | ||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 1,81 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
 |
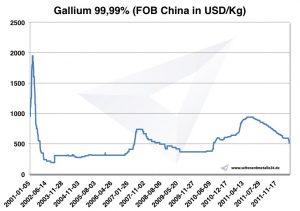
Диаграмма Галлий 2001-2011
Цены на галлий -> Цены на галлий в ценах на стратегические металлы
