Гафний - это химический элемент с символом Hf и атомным номером 72. Он назван в честь латинского названия города Копенгаген, Hafniaв котором элемент был обнаружен. Это серебристо-серый, блестящий, устойчивый к коррозии переходный металл, который находится в 4-й подгруппе (группа 4) или группе титана в периодической таблице.
Гафний по своим свойствам очень похож на цирконий, расположенный непосредственно над ним в периодической таблице. Биологические функции неизвестны, обычно не встречается в организме человека и не токсичен.
Гафний был одним из последних открытых элементов периодической таблицы. Первое указание на существование другого элемента между лютецием и танталом возникло из закона Мозли, найденного в 1912 году. В 1914 году Генри Мозли попытался найти неизвестный, но ожидаемый элемент с атомным номером 72 в соответствии с этим законом в образцах редкоземельных минералов (ныне лантаноидов). Но ему это не удалось.
В своей работе по теории атома, опубликованной в 1922 году, Нильс Бор предсказал, что ряд лантанидов с лютецием подошел к концу и что элемент 72 должен быть подобен цирконию. Гафний удалось обнаружить всего год спустя: в 1923 году в Копенгагене Дирк Костер и Джордж де Хевеши обнаружили его в норвежском цирконе с помощью рентгеновской спектроскопии. Дальнейшие исследования других минералов показали, что гафний всегда содержится в цирконийсодержащих минералах. Янцену и Хевеши удалось отделить их от циркония путем многократной кристаллизации фторидов диаммония и дикалия двух элементов. Тогда элементарный гафний может быть получен восстановлением натрием.
Вхождение
Гафний с содержанием 4,9 промилле в континентальной коре - элемент, который не очень распространен на Земле. По частоте он сравним с элементами брома и цезия и более распространен, чем давно известные золото и ртуть. Гафний не встречается в природе или в составе собственных минералов. С другой стороны, циркониевые минералы, такие как циркон и бадделеит, всегда содержат гафний; количество гафния обычно составляет 2% от содержания циркония (1-5% от веса гафния). Одним из немногих минералов, которые содержат больше гафния, чем циркония, является разновидность циркона Alvit [(Hf, Th, Zr) SiO4].
Аналогично цирконию, наиболее важными месторождениями гафния являются месторождения циркония в Австралии и Южной Африке. Запасы оцениваются в 1,1 млн тонн (в пересчете на оксид гафния)..
Извлечение и презентация
Чтобы получить гафний, его нужно отделить от циркония. Это невозможно во время производственного процесса, но происходит в отдельном процессе. Для разделения используются процессы экстракции. Используется различная растворимость некоторых солей циркония и гафния в специальных растворителях. Примерами этого являются разная растворимость нитратов в три-н-бутилфосфате и растворимость тиоцианатов в метилизобутилкетоне. Другими возможными вариантами разделения являются ионообменники и фракционная перегонка подходящих соединений.
После процесса Кролла отделенный гафний можно сначала превратить в хлорид гафния (IV), а затем восстановить до элементарного гафния с помощью натрия или магния.
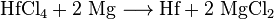
Если требуется даже более чистый гафний, можно использовать процесс Ван Аркеля де Бура. Во время нагревания в вакууме гафний сначала реагирует с йодом с образованием иодида гафния (IV). Он снова распадается на гафний и йод на горячей проволоке.

Гафний производится только в небольших количествах - 100 тонн. Он не производится собственными силами, но является побочным продуктом извлечения циркония без гафния для топливных стержней.
Свойства
Физические свойства

Кристаллическая структура α-Hf, a = 320 часов,c = 505 вечера
Гафний - серебристый, блестящий тяжелый металл высокой плотности (13,31 г / см3). Он кристаллизуется в двух различных модификациях в зависимости от температуры. В нормальных условиях он кристаллизуется в гексагональной плотной упаковке сфер (α-Hf) и поэтому изотипен α-Zr, при температуре выше 1775 ° C он превращается в объемно-центрированную кубическую структуру (β-Hf).
Если чистота гафния высока, он относительно мягкий и податливый. Легко работать прокаткой, ковкой и ковкой. С другой стороны, если в материале есть следы кислорода, азота или углерода, он становится хрупким и трудным для обработки. Точки плавления и кипения гафния самые высокие в группе при 2227 ° C и 4450 ° C (точка плавления: титан: 1667 ° C, цирконий: 1857 ° C).
Практически по всем остальным свойствам металл напоминает более легкий цирконий. Это вызвано сокращением лантаноидов, которое вызывает одинаковые атомные и ионные радиусы (атомные радиусы Zr: 159 мкм, Hf: 156 мкм). Исключение составляет цирконий с плотностью 6,5 г / смXNUMX.3 имеет значительно меньшее значение. Технически важное отличие состоит в том, что гафний может поглощать нейтроны в 600 раз лучше. Это причина того, что гафний необходимо отделить для использования циркония на атомных электростанциях.
Гафний является сверхпроводником ниже температуры перехода 0,08 К.
Химические свойства
Гафний - это неблагородный металл, который при нагревании реагирует с кислородом с образованием диоксида гафния. Другие неметаллы, такие как азот, углерод, бор и кремний, также образуют соединения в этих условиях. При комнатной температуре быстро образуется плотный оксидный слой, который пассивирует металл и защищает его от дальнейшего окисления.
Гафний стабилен в большинстве кислот из-за его пассивации при нормальных условиях. Он быстро корродирует в плавиковой кислоте, в то время как заметная коррозия происходит в горячей концентрированной серной и фосфорной кислотах. Смеси соляной кислоты и азотной кислоты, включая царскую водку, следует подвергать воздействию гафния только в течение короткого времени, даже при комнатной температуре; при 35 ° C следует ожидать скорости эрозии более 3 мм / год. На водных основах он устойчив до температуры около 100 ° C, удаление материала обычно составляет менее 0,1 мм / год.
Изотоп
Гафний имеет в общей сложности 35 изотопов и 18 основных изомеров 153Hf для 188Hf известно. Природный гафний - это смешанный элемент, состоящий из шести различных изотопов. Наиболее распространен изотоп с частотой 35,08%. 180Hf. Следует 178Hf с 27,28%, 177Hf с 18,61%, 179Hf с 13,62%, 176Hf с 5,27% и 174Hf 0,16%. Единственный природный изотоп - это 174Hf слабо радиоактивен, это альфа-излучатель с периодом полураспада 2 x 1015 Годы. Изотопы 177Hf и 179Hf можно обнаружить с помощью спектроскопии ЯМР.
Основной изомер 178 2mИмея период полураспада 31 год, HF является долгоживущим и в то же время излучает сильное гамма-излучение с энергией 2,45 МэВ при распаде. Это наивысшая энергия, которую излучает изотоп, стабильный в течение длительного периода времени. Одно из возможных приложений - использовать этот изомер ядра в качестве источника в мощных лазерах. В 1999 году Карл Коллинз обнаружил, что изомер может выделять свою энергию одним махом при воздействии рентгеновских лучей. Однако возможные применения, такие как взрывчатые вещества, маловероятны.
Использовать
Гафний лист из промышленных отходов
Поскольку его трудно извлечь, гафний используется только в небольших количествах. Основная область применения - ядерная технология, в которой гафний используется в качестве регулирующего стержня для регулирования цепной реакции в ядерных реакторах. Использование гафния имеет ряд преимуществ перед другими возможными веществами, поглощающими нейтроны. Элемент очень устойчив к коррозии, а ядерная реакция с нейтронами создает изотопы гафния, которые также имеют высокое сечение поглощения. Из-за своей высокой цены он часто подходит только для военных целей, например, для реакторов на атомных подводных лодках.
Есть еще несколько вариантов использования. Гафний быстро вступает в реакцию с небольшими количествами кислорода и азота и поэтому может использоваться в качестве геттерного вещества для удаления минимальных количеств этих веществ из систем сверхвысокого вакуума. При горении металл излучает очень яркий свет. Поэтому можно использовать гафний в импульсных лампах с особенно высокой светоотдачей. Из этих элементов можно получить несколько очень стабильных и тугоплавких соединений, особенно нитрид гафния и карбид гафния.
В сплавах с такими металлами, как ниобий, тантал, молибден и вольфрам, добавка 2% гафния увеличивает прочность. Создаются особо прочные, тугоплавкие и жаропрочные материалы.
безопасности
Как и многие другие металлы, гафний легко воспламеняется и пирофорен в мелкодисперсном состоянии. С другой стороны, в компактном состоянии он не горюч. Металл не токсичен. По этим причинам нет необходимости соблюдать специальные правила техники безопасности при обращении с гафнием.
Связи
Гафний образует ряд соединений. В основном это соли или смешанные кристаллы, часто имеющие высокие температуры плавления. Самая важная степень окисления гафния - + IV, но есть также соединения в более низких степенях окисления, от 0 до + III, а в комплексах также есть отрицательные степени окисления.
Гафний оксид (IV),
Оксид гафния (IV) - очень стабильное и тугоплавкое твердое вещество. Он имеет высокую относительную диэлектрическую проницаемость 25 (для сравнения: диоксид кремния: 3,9). Поэтому его можно использовать в качестве диэлектрика с высоким коэффициентом k для изоляции управляющего соединения (затвора) микропроцессоров. При дальнейшем уменьшении ширины структуры токи утечки становятся все большей проблемой, потому что миниатюризация КМОП-структур также требует более тонкой изоляции затвора. Нежелательный ток утечки резко возрастает ниже 2 нм из-за туннельного эффекта. Используя диэлектрик с высоким значением k, толщина диэлектрика может быть снова увеличена, чтобы уменьшить ток утечки без потери характеристик транзистора (снижение скорости переключения). Таким образом, более толстые диэлектрики допускают дальнейшую миниатюризацию.
Другие соединения гафния
Карбид гафния - одно из веществ с самой высокой температурой плавления. Вместе с нитридом гафния и боридом гафния он является одним из твердых материалов.
Есть некоторые известные галогенные соединения гафния. В степени окисления + IV существуют как фторид, так и хлорид, бромид и йодид. Хлорид гафния (IV) и йодид гафния (IV) играют роль в производстве гафния. В более низких степенях окисления известны только соединения хлора и брома и йодид гафния (III).
Гексафторидогафнат калия (IV) К2[HfF6] а также гексафторидогафнат аммония (IV) (NH)4)2[HfF6] можно использовать для отделения гафния от циркония, поскольку обе соли более растворимы, чем соответствующие комплексы циркония.
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Гафний, Hf, 72 | ||||||||||||||||||||||||||||||||||||||||||||||||
| серия | Переходные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 4, 6, д | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | стальной серый | ||||||||||||||||||||||||||||||||||||||||||||||||
| номер CAS | 7440-58-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 4,2 частей на миллион | ||||||||||||||||||||||||||||||||||||||||||||||||
| ядерной | |||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 178,49 XNUMX человека | ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 155 (208) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 150 м. | ||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Xe] 4f14 5d2 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ионизация | 658,5 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1440 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ионизация | 2250 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ионизация | 3216 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| физически | |||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | ||||||||||||||||||||||||||||||||||||||||||||||||
| изменения | два (α- / β-Hf) | ||||||||||||||||||||||||||||||||||||||||||||||||
| кристаллическая структура | шестиугольный | ||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 13,28 г / см3 (25 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| твердость по Моосу | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | парамагнитный ( = 7,0 10-5) = 7,0 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 2506 К (2233 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 4876 К (4603 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 13,44 · 10-6 m3/ моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 630 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 25,5 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| упругость паров | 0,00013 Па при 1970 К. | ||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 3010 м / с на 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 140 Дж / (кг · К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 3,12 · 106 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 23 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Химический | |||||||||||||||||||||||||||||||||||||||||||||||||
| состояния окисления | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | -1,505 В (HfO2 + 4 H.+ + 4 е- → Hf + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 1,3 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| свойства ЯМР | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||



