Вольфрам [ˈvɔlfram] - химический элемент с символом элемента W и порядковым номером 74. Это один из переходных металлов, в периодической таблице он находится в 6-й подгруппе (группа 6) или группе хрома. Вольфрам - это блестящий белый тяжелый металл высокой плотности, хрупкий в чистом виде. Из всех чистых металлов он имеет самую высокую температуру плавления и вторую по величине точку кипения. Поэтому его наиболее известным применением является нить накаливания в лампочках.
Еще в XVI веке минералог из Фрайберга Георгиус Агрикола описал наличие минерала в оловянных рудах Саксонии, что значительно затрудняло добычу олова из-за его шлакового содержания. Компонент названия «волк» происходит от этого свойства, так как минерал «съел» оловянную руду, как волк. Вопрос о том, был ли это вольфрамит, до сих пор остается предметом споров, поскольку он говорил о «легкости» минерала. Он назвал минерал Lupi Spumumчто в переводе с латинского означает «волчья пена». Позже он был назван Wolfram, от mhd. баран «Сажа, грязь», потому что черно-серый минерал легко измельчается и тогда напоминает сажу. Его химический символ W происходит от вольфрама.
Общее слово на английском, итальянском и французском вольфрама происходит от Тун Стен (По-шведски «тяжелый камень»). Это не означало, что сам Wolfram (швед. Вольфрам), но называется вольфраматом кальция. В 1781 году немецко-шведский химик Карл Вильгельм Шееле обнаружил в нем ранее неизвестную соль. Чистый вольфрам был впервые произведен в 1783 году испанскими братьями Фаустом и Хуаном Хосе Эльхуяром (работавшими под руководством Шееле) путем восстановления триоксида вольфрама, который извлекается из вольфрамита.
Вхождение
Содержание вольфрама в земной коре составляет около 0,0001 г / т или 0,0064 процента по весу (значение Кларка). Пока металл не удалось доказать в природе (в чистом виде). "Доклады Академии Наук" в России опубликовали отчет о твердом вольфраме в 1995 году, который не был изучен "Комиссией по новым минералам, номенклатуре и классификации" IMA (CNMNC). Известны некоторые минералы, особенно оксиды и вольфраматы. Наиболее важными вольфрамовыми рудами являются вольфрамит (Mn, Fe) WO.4 и шеелит CaWO4. Есть также другие минералы вольфрама, такие как Stolzit PbWO.4 и Tuneptit WO3 · H2O.
Самые крупные месторождения находятся в Китае, Перу, США, Корее, Боливии, Казахстане, России, Австрии и Португалии. Вольфрамовые руды также можно найти в Рудных горах. Безопасные и вероятные мировые месторождения в настоящее время составляют 2,9 миллиона тонн чистого вольфрама.
Наиболее важное известное место нахождения вольфрама в Европе находится в Felbertal в Высоком Тауэрне (штат Зальцбург в Австрии).
Продвижение по всему миру
В 2006 году мировое производство чистого вольфрама составило 73.300 80 тонн. Безусловно, крупнейшим производителем вольфрама является Китай. Здесь производится более 2006% производимого в мире вольфрама. Государства с наибольшим производством вольфрама (XNUMX г.):
| Позиция | Земля | Поставка (в тоннах в год) |
|---|---|---|
| 1 | Китай | 62.000 |
| 2 | Русский фед. | 4.500 |
| 3 | Канада | 2.500 |
| 4 | Österreich | 1.350 |
| 5 | Португалия | 900 |
| 6 | Северная Корея | 600 |
| 7 | Боливия | 530 |
| 8 | другие страны | 900 |
Продвижение в Австрии
В Австрии шеелит вольфрамовой руды был впервые обнаружен в 1815/16 году на золотом месторождении Шельгаден в муниципалитете Мур (штат Зальцбург). В результате во многих трещинах Высокого Тауэрна были обнаружены красивые кристаллы шеелита, иногда размером несколько сантиметров. Практического применения все эти находки не имели. Крупное месторождение в Felbertal пока оставалось неоткрытым.
В 1950 году стало известно, что большие количества шеелита появились в магнезитовом месторождении на Ванглальме около Ланерсбаха / Тукса (Тироль) в тылу Циллерталь, которое добывалось с 1927 года. Это крупный шеелит, сросший с магнезитом и кварцем. В последующие годы было извлечено около 10.000 1,8 тонн руды со средним содержанием оксида вольфрама 1960%, что представляет собой уникальное в мире высокое качество. Из-за низкой рыночной цены добыча вольфрама была остановлена в конце 1971-х годов, но возобновлена в 1976 году и продолжалась до закрытия магнезитовой шахты в XNUMX году.
1967 был в конечном итоге обнаружен крупнейшим шеелитворкомменом Европы в Фельбертале. Куски руды, присутствующие в потоках, были отслежены с использованием ультрафиолетового света (шеелитовые флуоресцентные лампы). Сложные геологоразведочные работы в высокогорной местности (самый высокий участок добычи на Brentling в 2100 на уровне моря) начался с 1971, изначально добыча над землей была зарегистрирована в Felbertal 1976 (из 1979 также подземная добыча, набор для добычи на поверхности 1986). С начала 1993 до середины 1995 добыча была временно приостановлена из-за низкой рыночной цены вольфрама.
Вольфрамовая руда из Фельбертала перерабатывается в соседнем Миттерзилле. Отсюда шеелитовый концентрат попадает в Санкт-Мартин-им-Зульмталь (Штирия). На месте подземного лигнитового рудника Pölfing-Bergla, который был закрыт в 1976 году, был построен вольфрамовый завод, в котором с 1977 года из концентратов из нескольких стран производились порошок оксида вольфрама, металлического вольфрама и карбида вольфрама.
Наиболее важные немецкие переработчики - HC Starck и Longyear GmbH.
Извлечение и презентация
Вольфрам нельзя получить из оксидных руд восстановлением углем, поскольку это приводит к карбиду вольфрама.
Добавление аммиачного раствора создает комплекс, называемый паравольфраматом аммония (APW). Его отфильтровывают, а затем преобразуют в относительно чистый триоксид вольфрама при 600 ° C. Оксид вольфрама (VI) (WO3), который восстанавливается до стального серого вольфрама при 800 ° C в атмосфере водорода:
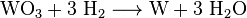
В результате образуется серый вольфрамовый порошок, который обычно прессуется в формах и электрически спекается в стержни. При температурах выше 3400 ° C компактный металлический вольфрам можно плавить в специальных электропечах с восстановительной водородной атмосферой (процесс зонной плавки).
Свойства
Физические свойства
Вольфрам - это блестящий белый металл, который можно растягивать в чистом виде, он обладает высокой твердостью, плотностью и прочностью. Плотность практически такая же, как у золота, твердость по Бринеллю 250 HB, предел прочности 550-620 Н / мм.2 (мягкий) до 1920 Н / мм2 (жесткий). Металл существует в стабильной объемноцентрированной кубической α-модификации с шагом плоскости решетки (= постоянная решетки) 316 пм при комнатной температуре. Такой тип кристаллической структуры часто называют типом вольфрама. С как метастабильная β-модификация вольфрама (искаженное в центре кубического тела), с другой стороны, это богатый вольфрамом оксид W3O.
После элемента углерода вольфрам имеет вторую по величине температуру плавления среди всех химических элементов - 3422 ° C. Точка кипения 5555 ° C превосходит только редкометалльный рений с 5596 ° C на 41 К.
Металл - сверхпроводник с температурой перехода 15 мК.
Химические свойства
Вольфрам - это химически очень стойкий металл, который почти не подвергается воздействию даже плавиковой кислоты и царской водки (по крайней мере, при комнатной температуре). Однако он растворяется в смесях фтористоводородной и азотной кислот и в расплавленных смесях нитратов и карбонатов щелочных металлов.
Изотоп
Известно 33 изотопа и 5 ядерных изомеров вольфрама. Из них 5 изотопов встречаются в природе. 180W, 182W, 183W, 184W и 186W. Изотоп вольфрама 184W имеет наибольшую частоту. Все 5 природных изотопов долгое время считались стабильными. Лишь в 2004 году эксперимент CRESST в Лаборатории националь-дель-Гран-Сассо смог доказать, что изотоп был вторичным результатом поиска темной материи. 180W подвержен альфа-распаду. Период полураспада составляет 1,8 триллиона лет, поэтому этот распад невозможно обнаружить в обычных лабораторных условиях. Радиоактивность этого природного изотопа настолько мала, что ею можно пренебречь для всех практических целей. Искусственные радиоактивные изотопы вольфрама, с другой стороны, имеют короткие периоды полураспада от 0,9 мс. 185W и 121,2 дней в 181W.
Использовать
Наиболее важное применение вольфрама из-за его высокой температуры плавления - в осветительной промышленности в качестве нити накала в лампах накаливания и в качестве электрода в газоразрядных лампах и электронных лампах.
В лампах используется тот факт, что электрическая проводимость вольфрама значительно ниже, чем у проводящих металлов меди и алюминия. В результате тонкая вольфрамовая нить накаливания нагревается до тех пор, пока не начинает светиться, в то время как более толстые выводы из проводящих металлов почти не нагреваются.
Он также имеет большое значение как легирующий металл в черной металлургии. Он образует карбиды вольфрама в инструментальных сталях, которые увеличивают вторичную твердость.
Благодаря своей высокой плотности он используется для балансировочных грузов и для защиты от излучения. Хотя его плотность и, следовательно, экранирующий эффект намного выше, чем у свинца, он используется для этой цели реже, чем свинец, поскольку он более дорогой и сложный в обработке. Кроме того, из-за высокой плотности вольфрама некоторые армии используют бронебойные боеприпасы с сердечником из карбида вольфрама вместо более дешевого, но радиоактивного и токсичного обедненного урана. Во время Второй мировой войны вольфрам сыграл важную роль в конструкции немецкого танка Panzerranate 40, который имел вольфрамовый сердечник. В будущем боеприпасы с вольфрамовым сердечником будут использоваться в новой боевой машине пехоты Puma, которая должна заменить Marder.
Из-за его высокой коррозионной стойкости, вольфрам также может быть использован в качестве материала для оборудования на химических заводах. Однако из-за плохой обрабатываемости вольфрама (вольфрам можно сваривать только лазерным или электронным лучом), этот вариант используется редко. То же самое относится к возможному применению в области медицинской техники.
В физиологии, особенно в нейрофизиологии, вольфрамовые микроэлектроды используются для внеклеточных записей.
Кроме того, электроды для сварочных процессов изготавливаются из вольфрама. Например, при контактной сварке, особенно при сварке таких материалов, как медь, бронза или латунь. Также при универсальной сварке TIG (вольфрамовым инертным газом) электрод изготавливается из вольфрама или его сплава. Эти электроды не расплавляются в процессе сварки. Дуга горит как плазма в защитном газе между электродом и компонентом. Материал наполнителя поставляется отдельно в виде стержней.
В спорте из вольфрама делают высококачественные стволы для дротиков, в стрельбе из лука из него делают наконечники для специальных стрел, а для метания молота из вольфрама также делали наконечники молотов для уменьшения сопротивления воздуха и радиуса вращения. Кроме того, вольфрамовые пластины используются в качестве дополнительных утяжелителей в Формуле 1 для достижения предписанного минимального веса автомобилей Формулы 1 (включая масло, тормоза и охлаждающую жидкость, а также водителей в гоночных комбинезонах и шлемах) в 620 кг (по состоянию на 2010 год). Некоторое время он также использовался крупными гонщиками в килевых бомбах во время плавания. Водонепроницаемость значительно снижена из-за большей плотности по сравнению с обычными материалами, такими как свинец или чугун. Существуют также теннисные ракетки, в раму из углеродного волокна которых встроены вольфрамовые волокна. Таким образом, определенные области рамы ракетки могут быть дополнительно стабилизированы для повышения точности игры.
При ловле нахлыстом нимфы и стримеры (приманка, ловимая под водой) утяжеляют вольфрамовыми бусинами, которые протыкают и надвигают на стержень крючка, чтобы они ныряли быстрее и глубже.
Струны музыкальных инструментов иногда наматывают вольфрамом, чтобы увеличить их вес и тем самым уменьшить высоту звука.
Вольфрам также используется в рентгеновской диагностике в качестве материала мишени для анода. В 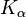 - и
- и 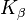 -Линии характеристического рентгеновского излучения составляют около 59 кэВ и 67 кэВ.
-Линии характеристического рентгеновского излучения составляют около 59 кэВ и 67 кэВ.
В сканирующей туннельной микроскопии в качестве материала наконечника зонда часто используется вольфрам.
С начала 21 века карбид вольфрама, ошибочно называемый вольфрамом, также использовался в ювелирных изделиях (украшения из вольфрама), например Б. кольца обработаны. Это очень легко определить по твердости и плотности. WC имеет твердость по Моосу 9,5, вольфрам только 7,5. До сих пор все детали ювелирных изделий, представленные на рынке, были сделаны из карбида вольфрама.
Физиология
Вольфрам считается положительным биоэлементом анаэробными бактериями типа Eubacterium acidaminophilum используется и включается в качестве кофактора в некоторые ферменты. E. acidaminophilum это бактерия, ферментирующая аминокислоты, которая использует вольфрам в ферментах формиатдегидрогеназе и альдегиддегидрогеназе. В этих организмах вольфрам заменяет молибден, потому что он гораздо чаще встречается в их естественной среде (вулканические жерла на морском дне).
токсикология
Согласно современным знаниям, вольфрам и его соединения считаются физиологически безвредными. Рак легких у рабочих на предприятиях по производству или переработке твердых металлов связан с присутствием кобальта.
На животной модели было обнаружено, что наибольшее количество перорально принимаемых соединений вольфрама быстро выводится с мочой. Небольшая часть вольфрама попадает в плазму крови, а оттуда в эритроциты. Затем он откладывается в почках и костной системе. Через три месяца после приема большая часть очень небольшого количества вольфрама, усваиваемого организмом, обнаруживается в костях.
В 2003 году в Фаллоне, штат Невада, где 16 детей страдали лейкемией с 1997 года, и в Сьерра-Виста, штат Аризона, где девять детей также страдали от рака крови, были выявлены два так называемых кластера рака - это местность с уровнем заболеваемости раком выше среднего. В обоих местах питьевая вода имеет исключительно высокие концентрации вольфрама. Значительно повышенные концентрации вольфрама были обнаружены в моче у населения. Оба места известны своими месторождениями вольфрамовой руды. Тем не менее, в ходе последующих примерно годичных исследований Центра по контролю за заболеваниями (CDC) прямой связи между вольфрамом и лейкемией установить не удалось. Вольфрам не показал канцерогенных эффектов ни в одном методе испытаний, и в других местах Невады не было обнаружено кластеров рака с такими же высокими значениями вольфрама в моче населения.
безопасности
Как порошок или пыль, он легко воспламеняется, не горюч в компактной форме.
Связи
Оксид
Вольфрам образует несколько оксидов. Между начальным членом:
- Вольфрам (VI) оксид WO3 - лимонно-желтый
и последний участник:
- Вольфрам (IV) оксид WO2 - коричневый
Есть ли другие промежуточные оксиды?
- W10O29 сине-фиолетовый, диапазон гомогенности WO2,92-Где2,88
- W4O11 красно-фиолетовый, диапазон гомогенности WO2,76-Где2,73
- W18O49ГДЕ2,72
- W20O50ГДЕ2,50
Другие соединения
- Вольфрамат натрия Na2WO4
- Вольфрамат циркония ZrW2O8 показывает аномалию при нагревании.
- Вольфрамовые бронзы MxWO3; M = щелочной металл, щелочноземельный металл, лантаноид, примерно 0.3 <x <0.9, обладают электропроводностью, интенсивностью и разной окраской в зависимости от содержания металла.
- Вольфрамат кальция CaWO4 известен как минерал под названием шеелит.
- Карбид вольфрама WC - чрезвычайно твердый металлоподобный состав. Также существует карбид Дивунграма W2C.
- Гексафторид вольфрама WF6
- Свинец вольфрамат PbWO4
- Дисульфид вольфрама WS2 Использовать в качестве сухой смазки (аналогично MoS2)
Использование соединений
Карбид вольфрама используется в качестве отражателя нейтронов в ядерном оружии для уменьшения критической массы. Карбиды вольфрама (твердый металл) используются при обработке материалов из-за их высокой твердости.
Вольфраматы используются для пропитки тканей, чтобы сделать их огнестойкими.
Вольфрамовые краски используются в живописи, а также в керамической и фарфоровой промышленности.
Вольфрамат свинца используется как современный сцинтиллятор в физике элементарных частиц.
| Общий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, атомный номер | Вольфрам, W, 74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| серия | Переходные металлы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 6, 6, д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серовато-белый, блестящий | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| номер CAS | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Массовая доля земной оболочки | 64 частей на миллион | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ядерной | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| атомная масса | 183,84 XNUMX человека | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус (рассчитанный) | 135 (193) вечера | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 162 м. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электронная конфигурация | [Xe] 4f145d46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ионизация | 770 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ионизация | 1700 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| физически | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физическое состояние | Праздник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кристаллическая структура | кубическое тело-центрированное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| плотность | 19,3 г / см3 (20 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| твердость по Моосу | 7,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| магнетизм | парамагнитный ( = 7,8 10-5) = 7,8 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| точка плавления | 3695 К (3422 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 5828 К (5555 ° С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 9,47 · 10-6 m3/ моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота парообразования | 824 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплота плавления | 35,4 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| скорость звука | 5174 м / с | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 138 Дж / (кг · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 18,52 · 106 А / (В · м) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| теплопроводность | 170 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химический | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| состояния окисления | 6, 5, 4, 3, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| нормальный потенциал | −0,119 В (WO2 + 4H+ + 4e- → W + 2H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| электроотрицательность | 2,36 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изотоп | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| свойства ЯМР | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| безопасности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
Фразы опасности H и P H: 228EUH: нет ставок EUHP: 210-240-241-280-370+378 Gefahrstoffkennzeichnung
 |
| легкий легковоспламеняющийся |
| (F) |
Порошок R- и S-фраз R: 11S: 43

